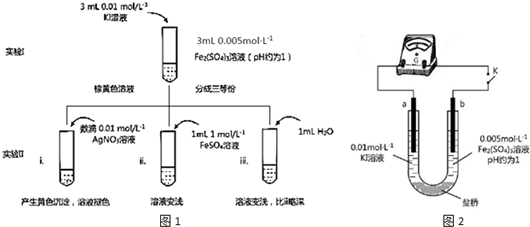
题目内容
11.反应A(g)+3B(g)?2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )| A. | V(D)=0.40 mol•L-1•s-1 | B. | V (C)=0.50 mol•L-1•s-1 | ||
| C. | V(B)=1.2 mol•L-1•min-1 | D. | V(A)=0.30 mol•L-1•s-1 |
分析 化学反应速率之比等于化学计量数之比,则化学反应速率与化学计量数的比值越大,反应速率越快,以此来解答.
解答 解:化学反应速率与化学计量数的比值越大,反应速率越快,则
A.$\frac{0.4}{2}$=0.2,
B.$\frac{0.5}{2}$=0.25,
C.$\frac{\frac{1.2}{60}}{3}$=0.007.,
D.$\frac{0.3}{1}$=0.3,
显然D中比值最大,反应速率最快,
故选D.
点评 本题考查反应速率的比较,为高频考点,把握化学反应速率与化学计量数的关系为解答的关键,侧重分析与应用能力的考查,注意比值法的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.最近中美研究人员发明了一种可快速充电放电的铝离子电池,该电池电解质为离子液体,离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液,放电过程中不产生其他离子且有机阳离子不参与电极反应,放电时有关离子转化如图所示,下列说法正确的是( )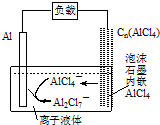

| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl7-+Cl- | |
| B. | 放电时,电路中每流过3mol电子,正极减少27g | |
| C. | 充电时,泡沫石墨极与外电源的负极相连 | |
| D. | 充电时,阴极发生:4Al2Cl7-+3e-=Al+7AlCl4- |
19.下列化学用语正确的是( )
| A. | 硫离子的结构示意图: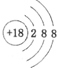 | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 电子转移情况: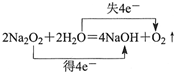 | D. | 氮分子的结构式:N≡N |
6.下列说法正确的是( )
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
 CH4(g)+H2O(g)△H=-203kJ•mol-1.
CH4(g)+H2O(g)△H=-203kJ•mol-1.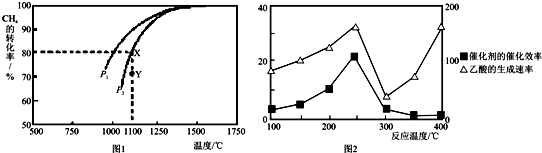

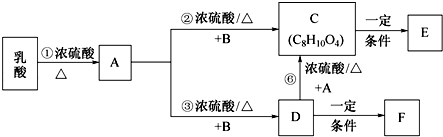
 .
. .
. .
.