题目内容
5.下列关于实验操作说法正确的是( )| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| B. | 中和滴定实验中,锥形瓶用蒸馏水洗净须经烤箱烘干后才可使用 | |
| C. | 配制0.5mol•L-1、480mL的NaOH溶液需称量9.6g的NaOH固体作溶质 | |
| D. | 某溶液中滴入2滴K3[Fe(CN)6]溶液生成具有特征蓝色的沉淀,说明原溶液中含有Fe2+ |
分析 A.苯萃取溴水中的溴时,有机层在上层;
B.锥形瓶用蒸馏水洗净即可使用;
C.结合m=cVM计算;
D.Fe2+与K3[Fe(CN)6]溶液反应生成蓝色沉淀.
解答 解:A.苯萃取溴水中的溴时,有机层在上层,则将溴的苯溶液从分液漏斗上口倒出,故A错误;
B.锥形瓶用蒸馏水洗净即可使用,不需要烤箱烘干,故B错误;
C.配制0.5mol•L-1、480mL的NaOH溶液需称量NaOH的质量为0.5mol/L×0.5L×40g/mol=10.0g,故C错误;
D.Fe2+与K3[Fe(CN)6]溶液反应生成蓝色沉淀,则溶液中滴入2滴K3[Fe(CN)6]溶液生成具有特征蓝色的沉淀,说明原溶液中含有Fe2+,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离、中和滴定、溶液配制、离子检验、实验技能为解答本题的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
15.下列有关性质的比较,错误的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>Br | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 熔点:K>Na |
16.由水电离出来的氢离子浓度为10-13 mol/L,在此溶液中一定能大量共存的离子组是( )
| A. | ClO-、K+、Cl- | B. | Ba2+、Na+、Br- | C. | Na+、Fe3+、SO42- | D. | K+、NO3-、NH4+ |
13.下列有关颜色变化的叙述不正确的是( )
| A. | 淀粉溶液中滴入碘水--变蓝色 | B. | KSCN溶液中滴入Fe3+--变血红色 | ||
| C. | 氯化银见光分解--变银白色 | D. | 无水硫酸铜在空气中久置--变蓝色 |
20.元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题.
(1)写出四种元素的元素符号:ANa、BN、CCl、DMg.
(2)A原子核外有4种能量不同的电子;写出D离子的核外电子排布式1s22s22p6.
(3)D和C形成的化合物R属于离子晶体;R的熔点高于四氯化碳,理由是R是离子晶体,固态四氟化碳是分子晶体
(4)A的金属性比D强,写出能证明该结论的一个事实金属钠能从熔融的氯化镁中置换出金属镁.
(5)设计一个简单实验,说明一水合氨是弱碱测定氯化铵溶液的pH值,测得其pH<7.
| 元素 | A | B | C | D |
| 性质 结构 信息 | 单质银白色,燃烧时火焰呈黄色. | 其单质是空气的主要成分,化学性质非常稳定. | 原子的3p亚层上有5个电子. | +2价阳离子的核外电子排布与氖原子相同. |
(2)A原子核外有4种能量不同的电子;写出D离子的核外电子排布式1s22s22p6.
(3)D和C形成的化合物R属于离子晶体;R的熔点高于四氯化碳,理由是R是离子晶体,固态四氟化碳是分子晶体
(4)A的金属性比D强,写出能证明该结论的一个事实金属钠能从熔融的氯化镁中置换出金属镁.
(5)设计一个简单实验,说明一水合氨是弱碱测定氯化铵溶液的pH值,测得其pH<7.
10.设NA为阿伏伽德罗常数.下列说法正确的是( )
| A. | 28.6g Na2CO3•10H2O晶体中CO32-数目等于0.1NA | |
| B. | 标准状况下,4.48L NO和2.24L O2完全反应后,容器内气体分子数为0.2NA | |
| C. | 0.1mol Na和氧气在一定条件下反应生成3.5g氧化物时,失去的电子数为0.2NA | |
| D. | 含有1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA |
14.实验室用NH4Cl固体和Ca(OH)2固体反应制备NH3,下列装置能达到相应实验目的是( )
| A. | 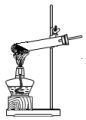 制备NH3 | B. | 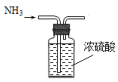 干燥NH3 | C. | 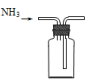 收集NH3 | D. | 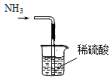 吸收多余NH3 |
14.下列溶液中持续通入CO2至过量,发生了化学反应,但所得分散系仍透明澄清的是( )
| A. | NaAlO2溶液 | B. | Na2SiO3溶液 | C. | BaCl2溶液 | D. | Ca(ClO)2溶液 |