题目内容
10.设NA为阿伏伽德罗常数.下列说法正确的是( )| A. | 28.6g Na2CO3•10H2O晶体中CO32-数目等于0.1NA | |
| B. | 标准状况下,4.48L NO和2.24L O2完全反应后,容器内气体分子数为0.2NA | |
| C. | 0.1mol Na和氧气在一定条件下反应生成3.5g氧化物时,失去的电子数为0.2NA | |
| D. | 含有1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA |
分析 A、1molNa2CO3•10H2O晶体中含1mol碳酸根;
B、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
C、钠反应后变为+1价;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、由于1molNa2CO3•10H2O晶体中含1mol碳酸根,28.6gNa2CO3•10H2O晶体的物质的量为0.1mol,故含0.1NA个碳酸根,故A正确;
B、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,故容器中的分子个数小于0.2NA个,故B错误;
C、钠反应后变为+1价,故0.1mol钠反应后失去0.1NA个电子,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1mol氯化铁形成的胶粒的个数小于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.过氧化钠是一种制氧剂,它和二氧化碳反应方程式为:2Na2O2+2CO2→2Na2CO3+O2下列说法正确的是( )
| A. | Na2O2是氧化剂,CO2是还原剂 | |
| B. | Na2CO3是还原产物,O2是氧化产物 | |
| C. | 每转移4摩尔电子,有1摩尔氧气生成 | |
| D. | 1摩尔CO2参加反应就会产生11.2LO2 |
1.用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是( )

| A. | 甲是原电池,乙是电解池 | |
| B. | 甲中铁棒比乙中铁棒更易腐蚀 | |
| C. | d电极上的电极反应是:Fe-2e→Fe2+ | |
| D. | b电极上的电极反应是:O2+2H2O+4e→4OH- |
18.检验苯甲醛中是否含有苯甲醇可用的试剂是( )
| A. | 金属钠 | B. | 银氨溶液 | C. | 新制氢氧化铜 | D. | 饱和食盐水 |
5.下列关于实验操作说法正确的是( )
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| B. | 中和滴定实验中,锥形瓶用蒸馏水洗净须经烤箱烘干后才可使用 | |
| C. | 配制0.5mol•L-1、480mL的NaOH溶液需称量9.6g的NaOH固体作溶质 | |
| D. | 某溶液中滴入2滴K3[Fe(CN)6]溶液生成具有特征蓝色的沉淀,说明原溶液中含有Fe2+ |
15.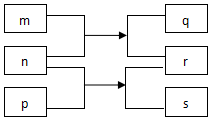 短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径大小:Y>Z>W | |
| B. | 简单气态氢化物的稳定性:R>Y | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | 单质熔点:Z>R>X |
2.用下列装置完成相关实验,合理的是( ) )
| A. | 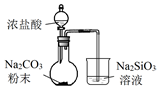 验证H2CO3酸性强于H2SiO3 | B. | 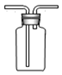 收集CO2或NH3 | ||
| C. | 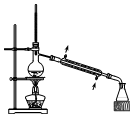 分离Na2CO3溶液与CH3COOC2H5 | D. | 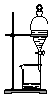 分离CH3CH2OH与CH3COOC2H5 |
19.在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
| A. | 完全中和所需NaOH的量 | B. | CH3COOH的电离程度 | ||
| C. | 溶液中H+的物质的浓度 | D. | CH3COOH的物质的量 |
19.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:下列说法不正确的是( )


| A. | ③步操作中所用到的玻璃仪器有:漏斗、烧杯、玻璃棒 | |
| B. | ④步反应的离子方程式可以是:2I-+H2O2+2H+=I2+2H2O | |
| C. | ⑤步的操作名称是萃取与分液,其中Z是萃取剂,Z可以是乙醇 | |
| D. | ⑥步的操作名称是蒸馏 |