题目内容
14.下列溶液中持续通入CO2至过量,发生了化学反应,但所得分散系仍透明澄清的是( )| A. | NaAlO2溶液 | B. | Na2SiO3溶液 | C. | BaCl2溶液 | D. | Ca(ClO)2溶液 |
分析 A、NaAlO2 与过量的二氧化碳反应生成碳酸氢钠和氢氧化铝;
B、Na2SiO3溶液能和过量的二氧化碳反应生成硅酸沉淀和碳酸氢钠溶液;
C、二氧化碳和氯化钡不反应;
D、Ca(ClO)2溶液能和过量的二氧化碳反应生成碳酸氢钙和HClO;
解答 解:A.NaAlO2 与过量的二氧化碳反应生成碳酸氢钠和氢氧化铝,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,氢氧化铝为沉淀,且当二氧化碳过量时不能溶解,故所得分散系不是透明澄清,故A错误;
B、Na2SiO3溶液能和过量的二氧化碳反应生成硅酸沉淀和碳酸氢钠溶液:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3,硅酸是一种白色沉淀,故所得溶液不是澄清透明,故B错误;
C、由于碳酸的酸性弱于盐酸,故二氧化碳和氯化钡溶液不反应,故C错误;
D、Ca(ClO)2溶液通入二氧化碳发生反应:Ca(ClO)2+2CO2+2H2O=Ca(HCO3)2+2HClO,无沉淀产生,故所得分散系为澄清透明的,故D正确.
故选D.
点评 本题考查了碳的氧化物及其对应碳酸盐和碳酸氢盐的性质,题目难度不大,注意碳酸钠和碳酸氢钠溶解性的差别.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
5.下列关于实验操作说法正确的是( )
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| B. | 中和滴定实验中,锥形瓶用蒸馏水洗净须经烤箱烘干后才可使用 | |
| C. | 配制0.5mol•L-1、480mL的NaOH溶液需称量9.6g的NaOH固体作溶质 | |
| D. | 某溶液中滴入2滴K3[Fe(CN)6]溶液生成具有特征蓝色的沉淀,说明原溶液中含有Fe2+ |
5.一定温度下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,溶液pH变化的曲线如图所示.下列叙述中正确的是( )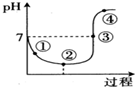

| A. | 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) | |
| B. | 点②所示溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
2.下列有关说法正确的是( )
| A. | 氮氧化合物、PM 2.5颗粒、CO2都会导致酸雨 | |
| B. | 氯水和二氧化硫混合使用能增强漂白效果 | |
| C. | 硫酸铜溶液可用于泳池消毒是利用了Cu2+能使蛋白质盐析 | |
| D. | 轮船上挂锌锭防止铁腐蚀属于牺牲阳极的阴极保护法 |
19.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:下列说法不正确的是( )


| A. | ③步操作中所用到的玻璃仪器有:漏斗、烧杯、玻璃棒 | |
| B. | ④步反应的离子方程式可以是:2I-+H2O2+2H+=I2+2H2O | |
| C. | ⑤步的操作名称是萃取与分液,其中Z是萃取剂,Z可以是乙醇 | |
| D. | ⑥步的操作名称是蒸馏 |
6.下列说法错误的是( )
| A. | 纯铁比生铁更耐腐蚀 | |
| B. | 明矾水解形成胶体能吸附悬浮物,可用于净水 | |
| C. | 碳酸钠溶液呈碱性是因为其在水中电离出OH- | |
| D. | 工业废水中的Cu2+和Hg2+可用Na2S或H2S除去 |
3.下列说法摘自某些刊物,你认为无科学性错误的是( )
| A. | 铅笔芯的原料是铅,儿童用嘴咬铅笔会导致铅中毒 | |
| B. | 在生有煤炉的居室里放一盆水,可以防止CO中毒 | |
| C. | 在农作物温室大棚内燃烧煤,产生的CO2不利于植物的生长 | |
| D. | 高纯硅应用在半导体元件与集成芯片之中,所以说“硅是信息技术革命的催化剂” |
4.下列叙述正确的是( )
| A. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| B. | 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向Na2CO3饱和溶液中,通入过量的CO2后,加热蒸干得NaHCO3晶体 |
 NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下
NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下