题目内容
11.下列物质属于纯净物的是( )| A. | 空气 | B. | 氨水 | C. | 矿泉水 | D. | 蒸馏水 |
分析 相同物质组成的为纯净物,不同物质组成的为混合物,据此分析选项中物质分类.
解答 解:A.空气是氧气、氮气、二氧化碳、稀有气体等组成的混合物,故A错误;
B.氨水是氨气的水溶液属于混合物,故B错误;
C.矿泉水是含电解质的水溶液属于混合物,故C错误;
D.蒸馏水是一种物质组成的纯净物,故D正确;
故选D.
点评 本题考查了物质分类、物质组成、物质名称等知识点,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
1.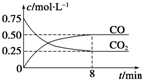 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
(1)0~8min,v(CO)=0.0625mol•L-1•min-1.
(2)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是AD(填序号).
A.温度B.铁粉的量(足量)C.压强D.CO的量
(3)已知:反应Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2.不同温度时K1、K2的值如下表:
根据表中数据,计算反应CO2(g)+H2(g)?CO(g)+H2O(g)的K.
①温度为973K时:K=0.62;
②温度为1173K时:K=1.29;
③反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:(1)0~8min,v(CO)=0.0625mol•L-1•min-1.
(2)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是AD(填序号).
A.温度B.铁粉的量(足量)C.压强D.CO的量
(3)已知:反应Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2.不同温度时K1、K2的值如下表:
| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
①温度为973K时:K=0.62;
②温度为1173K时:K=1.29;
③反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
19.下列物质中,既有离子键,又含有共价键的物质是( )
| A. | H2SO4 | B. | CO2 | C. | NaOH | D. | HNO3 |
6.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的物质是( )
①NaHCO3②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3 ⑥Na[Al(OH)4].
①NaHCO3②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3 ⑥Na[Al(OH)4].
| A. | ①②③④⑤ | B. | ①②③⑤ | C. | ①②③ | D. | 全部 |
3.下列关于平衡体系的各说法中不正确的是( )
| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 在H2S?H++HS-的平衡体系升温到100℃时,溶液中的c(H+)一定增大 | |
| D. | 在盐酸中加入KCl晶体,溶液pH不变 |
20.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.据此下列叙述不正确的是( )
| A. | 该反应是吸热反应 | |
| B. | 生成物的总能量低于反应物的总能量 | |
| C. | 导致醋酸凝固的原因:该反应吸热使大烧杯中的热能转化为小烧杯中产物的内能 | |
| D. | 该反应的热化学方程式为:NH4HCO3(s)+HCl(aq)=NH4Cl(aq)+CO2(g)+H2O(l)△H=+Q kJ•mol-1 |
1.氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如图:

(1)由FeCl3•6H2O晶体制备无水FeCl3应采取的措施是:在通HCl气体的氛围下加热.
(2)六水合氯化铁在水中的溶解度如下:
从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入少量盐酸、加热浓缩、冷却结晶、过滤、洗涤、干燥.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=2.6×10-9mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39)
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol•L-1Na2S2O3溶液滴定用去12.50mL.
已知:I2+2S2O32-=2I-+S4O62-
①写出加入稍过量的KI溶液反应的离子方程式:2Fe3++2I-=2Fe2++I2.
②求样品中氯化铁的质量分数(写出计算过程)

(1)由FeCl3•6H2O晶体制备无水FeCl3应采取的措施是:在通HCl气体的氛围下加热.
(2)六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=2.6×10-9mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39)
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol•L-1Na2S2O3溶液滴定用去12.50mL.
已知:I2+2S2O32-=2I-+S4O62-
①写出加入稍过量的KI溶液反应的离子方程式:2Fe3++2I-=2Fe2++I2.
②求样品中氯化铁的质量分数(写出计算过程)
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.