题目内容
10.下列说法正确的是( )| A. | 乙烯与氯气反应生成的产物仍为平面结构 | |
| B. | 甲烷可以与氯气发生反应,因此可以使氯水褪色 | |
| C. | CHCl3只有一种结构,能说明甲烷是正四面体结构 | |
| D. | 邻二氯苯只有一种结构,说明苯环不是单双键交替结构 |
分析 A.乙烯为平面结构,乙烯与氯气加成后C为四面体构型;
B.甲烷与氯水不反应;
C.无论甲烷为正四面体还是正方形,CHCl3均有一种结构;
D.邻二氯苯只有一种结构,可知苯环上不含碳碳双键、单键.
解答 解:A.乙烯为平面结构,乙烯与氯气加成后C为四面体构型,则加成产物不是平面结构,故A错误;
B.甲烷与氯水不反应,不能使氯水褪色,故B错误;
C.无论甲烷为正四面体还是正方形,CHCl3均有一种结构,则CH2Cl2只有一种结构,能说明甲烷是正四面体结构,故C错误;
D.邻二氯苯只有一种结构,可知苯环上不含碳碳双键、单键,则说明苯环不是单双键交替结构,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应、有机物的结构等为解答的关键,侧重分析与应用能力的考查,注意结构的判断,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
20.在2A+B?3C+5D反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.8 mol•L-1•s-1 | D. | v (D)=1 mol•L-1•s-1 |
5.某工业生产经过以下转化步骤:
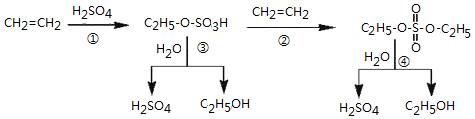
下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 该过程可以制取乙醇 | |
| B. | 已知C2H5-O-SO3H属于酯,所以该过程中①和②都是酯化反应 | |
| C. | 该过程中③和④是取代反应 | |
| D. | C2H5-O-SO3H具有酸性 |
15.利用下列反应不能制得括号中纯净物的是 ( )
| A. | 等物质的量氯气与乙烷在光照条件下反应(氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| D. | 乙烯与氢气加成(乙烷) |
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 46gNO2和N2O4的混合气体中含有的原子个数为3NA | |
| B. | 标准状况下,22.4L乙醇完全燃烧后生成的CO2分子数为2NA | |
| C. | 1mol苯中所含的碳碳双键数为3NA | |
| D. | 1mol Cl2与过量Fe反应,转移的电子数为3NA |
1.已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:CH3CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$ CH3COONa+Cu2O↓+3H2O某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5mL 40%的乙醛溶液进行下列实验.
(1)上表中a、b应为B(填字母序号).
A.15滴,1mL B.2mL,1mL C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
A.15滴,1mL B.2mL,1mL C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
 、
、 .
.

