题目内容
1.如是元素周期表的一部分,表中所列的字母分别代表某一化学元素. 、
、(1)表中所列元素中,化学性质最不活泼的是Ar(用元素符号表示,下同),金属性最强的是K,非金属性最强的是F,在短周期主族元素中原子半径最大是Na,属于过渡元素的是e(该空用字母表示).
(2)元素g形成单质重要用途作半导体等.
(3)用电子式表示元素d和j形成的化合物的过程
 .
.(4)向元素f和j形成的化合物的溶液中,滴加NaOH溶液至过量,观察到的实验现象为先生成沉淀,后沉淀溶解,写出发生反应的化学反应方程式AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=Na[Al(OH)4].
分析 由元素在周期表的位置可知,a为H,b为Na,c为Mg,d为Ca,e为Fe,f为Al,h为C,i为N,K为F,j为Cl,m为Ar,n为K,g为Ge,
(1)稀有气体性质最不活泼,同周期从左向右金属性减弱、非金属性增强,同主族从上到下非金属性减弱、金属性增强;同周期从左向右原子半径减小,电子层越多,原子半径越大;副族元素及ⅤⅢ族元素为过渡元素;
(2)Ge位于金属与非金属的交界处;
(3)d和j形成的化合物为CaCl2,为离子化合物;
(4)f和j形成的化合物为氯化铝,与NaOH反应先生成沉淀,后溶解.
解答 解:由元素在周期表的位置可知,a为H,b为Na,c为Mg,d为Ca,e为Fe,f为Al,h为C,i为N,K为F,j为Cl,m为Ar,n为K,g为Ge,
(1)表中所列元素中,化学性质最不活泼的是Ar,金属性最强的是K,非金属性最强的是F,在短周期主族元素中原子半径最大是Na,属于过渡元素的是e,
故答案为:Ar;K;F;Na;e
(2)元素g形成单质重要用途为作半导体等,故答案为:作半导体等;
(3)d和j形成的化合物为CaCl2,为离子化合物,用电子式表示形成过程为 ,
,
故答案为: ;
;
(4)向元素f和j形成的化合物的溶液中,滴加NaOH溶液至过量,观察到的实验现象为先生成沉淀,后沉淀溶解,发生反应的化学反应方程式为AlCl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+NaOH=Na[Al(OH)4],
故答案为:先生成沉淀,后沉淀溶解;AlCl3+3NaOH=Al(OH)3↓+3NaCl;Al(OH)3+NaOH=Na[Al(OH)4].
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识及元素化合物知识的应用,题目难度不大.

 灵星计算小达人系列答案
灵星计算小达人系列答案| A. | 向某溶液中加AgNO3溶液产生白色沉淀,证明有Cl- | |
| B. | 向某溶液中加稀HCl,无明显现象,再加入BaCl2溶液产生白色沉淀,证明有SO42- | |
| C. | 除去稀HCl中的少量H2SO4,可加入适量的Ba(NO3)2后再过滤 | |
| D. | 除去NaCl溶液中少量的Na2CO3,可加入适量的H2SO4溶液 |
| A. | CH3CH2Cl | B. | CH2Cl-CH2Cl | C. |  | D. |  |
| A. | Cu | B. | CaCO3 | C. | Zn | D. | AgNO3 |
| A. | Na和Na+ | B. | 35Cl和37Cl | ||
| C. | 14N和 14C | D. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2 |
 研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).
研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).(1)已知一定压强下,该反应在温度升高时,CH3OCH3(g)的浓度增大,则反应的焓变△H>0,熵变△S<0(分别填“>”、“<”、或“=”).
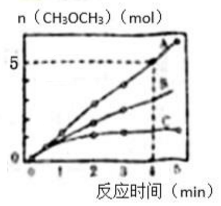
(2)相同条件下,在体积为2L的密闭容器内选用不同的催化剂,生成物二甲醚CH3OCH3的量随时间变化如图所示.
①图中0-4min内的反应速率v(CO2)=1.25mol•(L•min)-1.该温度下平衡常数的表达式为$\frac{{c(C{H_3}OC{H_3})}}{{{c^2}(C{O_2}){c^6}({H_2})}}$.
②下列有关说法正确的是ABC(填字母序号).
A.反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C)
B.升高温度能使反应速率加快,是因为活化分子百分数增大
C.单位时间内消耗CO2与生成H2的数目为2:1时,说明反应已经达到平衡
D.增大压强,平衡正向移动,平衡常数K值增大
(3)温度下,在体积可变的密闭容器中,改变起始时各物质的起始投料量,在不同的压强下,平衡时生成物二甲醚CH3OCH3(g)的物质的量如表所示:
| 序号 | 起始投料量不同的压强下, 平衡CH3OCH3(g)的量不同的压强 | P1 | P2 | P3 |
| I | 2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
| II | 1.0molCO2 3.0molH2 | X1 | Y1 | Z1 |
| III | 1.0mol CH3OCH3 3.0mol H2O | X2 | Y2 | Z2 |
②X1=0.05mol.
③P2下,III中CH3OCH3的平衡转化率为96%.
| A. | 乙烯与氯气反应生成的产物仍为平面结构 | |
| B. | 甲烷可以与氯气发生反应,因此可以使氯水褪色 | |
| C. | CHCl3只有一种结构,能说明甲烷是正四面体结构 | |
| D. | 邻二氯苯只有一种结构,说明苯环不是单双键交替结构 |
| A. | 10% | B. | 11.1% | C. | 0.1% | D. | 20% |