题目内容
12.在空气中,下列有机物完全燃烧的产物不都是氧化物的是( )| A. | 氯乙烯 | B. | 丙烷 | C. | 苯 | D. | 乙醇 |
分析 氧化物是两种元素组成其中一种为氧元素的化合物,有机物中含碳氢的烃和含碳、氢、氧元素组成的烃的衍生物完全燃烧生成水和二氧化碳都为氧化物,结合有机物组成元素分析燃烧产物.
解答 解:A.氯乙烯含有氧元素、氢元素、氯元素,燃烧产物有二氧化碳、水和氯化氢,不全是氧化物,故A符合;
B.丙烷为烃,完全燃烧生成二氧化碳和水,都是氧化物,故B不符合;
C.苯属于烃完全燃烧生成二氧化碳和水,都是氧化物,故C不符合;
D.乙醇含碳、氢、氧三种元素,完全燃烧生成二氧化碳和水,都是氧化物,故D不符合;
故选A.
点评 本题考查了有机物组成、性质、燃烧产物判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
2. 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:

A、乙醇 B、Ca(OH)2或Ba(OH)2C、NaOH溶液.
(1)B中盛装的试剂Ca(OH)2或Ba(OH)2(填化学式)
(2)A中加入乙醇的目的是除去H2C2O4,避免对CO2的检验造成干扰.
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4•2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是C2O42-+H2O?HC2O4-+OH-(用离子方程式表示).
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:□MnO4-+□H2C2O4+□6H+=□Mn2++□CO2↑+□H2O
(1)配平上述离子方程式.
(2)滴定时KMnO4溶液应盛装于酸式(填“酸式”或“碱式”)滴定管中.
Ⅱ、探究影响化学反应速率的因素
如表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是探究KMnO4溶液浓度对化学反应速率的影响;
(2)根据表中数据在右边坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图象;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是氯离子可与酸性高锰酸钾发生氧化还原反应.
 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:

A、乙醇 B、Ca(OH)2或Ba(OH)2C、NaOH溶液.
(1)B中盛装的试剂Ca(OH)2或Ba(OH)2(填化学式)
(2)A中加入乙醇的目的是除去H2C2O4,避免对CO2的检验造成干扰.
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4•2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是C2O42-+H2O?HC2O4-+OH-(用离子方程式表示).
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:□MnO4-+□H2C2O4+□6H+=□Mn2++□CO2↑+□H2O
(1)配平上述离子方程式.
(2)滴定时KMnO4溶液应盛装于酸式(填“酸式”或“碱式”)滴定管中.
Ⅱ、探究影响化学反应速率的因素
如表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
| 实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6′55″ | (a)探究KMnO4溶液浓度对化学反应速率的影响 |
| 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | ||
| 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | ||
| 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | ||
| 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | ||
| 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
(1)实验目的(a)是探究KMnO4溶液浓度对化学反应速率的影响;
(2)根据表中数据在右边坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图象;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是氯离子可与酸性高锰酸钾发生氧化还原反应.
3.CO(g)+H2O(g)?H2(g)+CO2(g),△H<0,在其它条件不变的情况下( )
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 增加反应物的浓度平衡向正向移动,平衡常数增加 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 改变压强,平衡不发生移动,反应放出的热量不变 |
20.某研究性学习小组为测定花溪河水中 Ca2+的含量,取样 100mL,经测定其中含 Ca2+的质量为 4mg,则该河水中 Ca的物质的量浓度为( )
| A. | 1×10-4mol/L | B. | 1×10-3mol/L | C. | 4×10-4mol/L | D. | 4×10-3mol/L |
7.25℃时,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,当混合溶液的pH=10时,酸和碱的体积之比为( )
| A. | 10:1 | B. | 9:1 | C. | 1:9 | D. | 1:10 |
17.柠檬烯是一种食用香料,其结构简式为: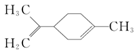 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )
 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 它在核磁共振氢谱中有6个峰 | B. | 它能发生取代、加成和氧化反应 | ||
| C. | 它与丁基苯互为同分异构体 | D. | 它属于芳香族化合物 |
4.下有关事实或解释均正确的是( )
| 选项 | 事 实 | 解 释 |
| A | 锌与盐酸反应,加入氯化钠溶液,速率加快 | 增大了氯离子的浓度,使反应速率增加 |
| B | 锌与稀硫酸反应,加入较多硫酸铜溶液,生成氢气的速率加快 | 形成铜锌原电池,使生成氢气的速率加快 |
| C | 在5%的双氧水中加入二氧化锰粉末,分解速率迅速加快 | 降低了反应的焓变,活化分子数增多,有效碰撞增多,反应速率加快 |
| D | 面粉成产车间容易发生爆炸 | 固体表面积大,反应速率加快 |
| A. | A | B. | B | C. | C | D. | D |
9.实验室里需要480mL 0.100mol/L的CuSO4溶液,以下操作正确的是( )
| A. | 称取7.68gCuSO4,加入500mL水 | |
| B. | 称取12.5g胆矾,配成480mL溶液 | |
| C. | 称取8.0gCuSO4,加入到500mL水中配成溶液 | |
| D. | 称取12.5g胆矾,配成500mL溶液 |