题目内容
石油和煤都是重要的能源和化工原料,如图1是煤化工产业链的一部分.
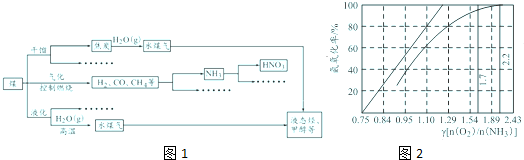
试用所学知识,解决下列问题:
(1)柴油是由石油加工得到的重要产品,它在燃烧时往往冒黑烟,可能的原因是
(2)煤经过干馏可以得到焦炉气、煤焦油和焦炭等.煤焦油经过 (填加工方法)可得到芳香族化合物.
(3)煤的直接液化是煤和适当溶剂混合在高温和 存在下与 作用生成液态燃料的过程.
(4)煤和石油等化石燃料燃烧排放的大量二氧化碳会引起全球气候变暖.一种新的处理方法是将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达60%)成分的水溶液里,其中一种反应的化学方程式:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,则X的化学式为 .
(5)在煤燃烧前需对煤进行脱硫处理.煤的某种脱硫技术的原理如图2所示:
FeS2
→Fe2++SO42-
→Fe3+这种脱硫技术称为微生物脱硫技术.该技术的第一步反应的离子方程式为 ,第二步反应的离子方程式为 .
(6)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨--空气混合气体中氧氨比的关系.其中直线表示反应的理论值;曲线表示实际生产情况.当氨氧化率达到100%,理论上γ[n(O2)/n(NH3)]= ,实际生产将γ维持在1.7~2.2之间,原因是 .

试用所学知识,解决下列问题:
(1)柴油是由石油加工得到的重要产品,它在燃烧时往往冒黑烟,可能的原因是
(2)煤经过干馏可以得到焦炉气、煤焦油和焦炭等.煤焦油经过
(3)煤的直接液化是煤和适当溶剂混合在高温和
(4)煤和石油等化石燃料燃烧排放的大量二氧化碳会引起全球气候变暖.一种新的处理方法是将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达60%)成分的水溶液里,其中一种反应的化学方程式:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,则X的化学式为
(5)在煤燃烧前需对煤进行脱硫处理.煤的某种脱硫技术的原理如图2所示:
FeS2
| 在微生物作用下 |
| O2/H2O |
| 在微生物作用下 |
| O2/H+ |
(6)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨--空气混合气体中氧氨比的关系.其中直线表示反应的理论值;曲线表示实际生产情况.当氨氧化率达到100%,理论上γ[n(O2)/n(NH3)]=
考点:煤的干馏和综合利用,工业制取硝酸,石油的裂化和裂解
专题:
分析:(1)含碳物质不充分燃烧会产生黑烟;
(2)芳香族化合物的沸点不同;
(3)煤的直接液化是煤在高温和催化剂存在下与H2O作用生成液体燃料的过程;
(4)据质量守恒判断x的化学式;
(5)根据化合价升降总数相等以及原子守恒来写离子方程式;
(6)根据氨氧化的化学方程式来分析;根据O2浓度对平衡的影响.
(2)芳香族化合物的沸点不同;
(3)煤的直接液化是煤在高温和催化剂存在下与H2O作用生成液体燃料的过程;
(4)据质量守恒判断x的化学式;
(5)根据化合价升降总数相等以及原子守恒来写离子方程式;
(6)根据氨氧化的化学方程式来分析;根据O2浓度对平衡的影响.
解答:
解:(1)如果燃烧时氧气不充足,会不完全燃烧,有碳颗粒生成,会有黑烟产生,故答案为:燃烧时氧气不充足;
(2)从煤焦油中得到芳香族化合物常用分馏的方法制备,故答案为:分馏;
(3)煤的直接液化是煤与适当溶剂混合后在高温和催化剂存在下与H2O作用生成液体燃料的过程,故答案为:催化剂;水;
(4)根据化学方程式:KAlSi3O8+CO2+2H2O═KHCO3+X+3SiO2↓和质量守恒定律分析,反应前K:1个,反应后:1个,则x中不含K;反应前Al:1个,反应后应:1个,则x中含有一个Al,依此类推,x中还含有3个O,3个H,则X的化学式为 Al(OH)3,故答案为:Al(OH)3;
(5)第一步反应中反应物有FeS2、O2和H2O,生成物有Fe2+和SO42-,根据化合价升降总数相等以及原子守恒,反应的离子方程式为:2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;Fe2+具有还原性,可被氧气氧化为Fe3+,根据化合价升降总数相等以及原子守恒,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;4Fe2++O2+4H+=4Fe3++2H2O;
(6)由氨氧化的化学方程式:4NH3+5O2
4NO+6H2O,可知氨氧化率达到100%,理论上γ{n(O2)/n(NH3)}=
=1.25,故答案为:1.25;
O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%,故答案为:O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%.
(2)从煤焦油中得到芳香族化合物常用分馏的方法制备,故答案为:分馏;
(3)煤的直接液化是煤与适当溶剂混合后在高温和催化剂存在下与H2O作用生成液体燃料的过程,故答案为:催化剂;水;
(4)根据化学方程式:KAlSi3O8+CO2+2H2O═KHCO3+X+3SiO2↓和质量守恒定律分析,反应前K:1个,反应后:1个,则x中不含K;反应前Al:1个,反应后应:1个,则x中含有一个Al,依此类推,x中还含有3个O,3个H,则X的化学式为 Al(OH)3,故答案为:Al(OH)3;
(5)第一步反应中反应物有FeS2、O2和H2O,生成物有Fe2+和SO42-,根据化合价升降总数相等以及原子守恒,反应的离子方程式为:2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;Fe2+具有还原性,可被氧气氧化为Fe3+,根据化合价升降总数相等以及原子守恒,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;4Fe2++O2+4H+=4Fe3++2H2O;
(6)由氨氧化的化学方程式:4NH3+5O2
| ||
| 高温高压 |
| 5 |
| 4 |
O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%,故答案为:O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%.
点评:本题考查煤的综合利用,涉及到氧化还原方程式的书写,题目难度中等,本题注意从题目中获取信息,结合物质的性质解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列仪器中,在洗净后需要烘干的是( )
| A、配制一定物质的量浓度的溶液所用的容量瓶 |
| B、收集氨微喷泉实验所用的圆底烧瓶 |
| C、中和滴定实验中的酸式滴定管 |
| D、中和滴定实验中的锥形瓶 |
下列说法正确的是( )
| A、制作航天服的聚酯纤维和用于制光缆的光导纤维都是新型无机非金属材料 |
| B、使用太阳能、风能等清洁能源能减少PM2.5的污染 |
| C、水泥、玻璃、水晶饰物都是硅酸盐制品 |
| D、用浸泡过溴的四氯化碳溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 |
垃圾分类从你我他开始.废弃塑料瓶属于( )
A、 |
B、 |
C、 |
D、 |

 (其中-x、一y均为官能团).请回答下列问题:
(其中-x、一y均为官能团).请回答下列问题: