题目内容
2.国际化学命名委员会在1978年作出决定.把周期表原先的主、副族及族号取消,由左到右改为第1~18列.碱金属族为第1列,稀有气体为第18列,按规定下列说法正确的是( )| A. | 第1列和第2列元素都是金属元素 | |
| B. | 只有第2列元素原子的最外层是2个电子 | |
| C. | 第16列和第17列元素都只能以化合态存在于自然界中 | |
| D. | 第17列元素的单质熔、沸点逐渐升高 |
分析 由左到右改为第1~18列.碱金属族为第1列,稀有气体为第18列,则第2列为碱土金属,第16列为氧族元素,第17列元素为卤素,以此来解答.
解答 解:A.第1列中H为非金属元素,故A错误;
B.第2列、He及某些过渡元素原子的最外层是2个电子,故B错误;
C.第16列中O元素的单质在空气中含量较多,在火山口有单质硫,故C错误;
D.第17列元素的单质为分子晶体,相对分子质量越大,熔沸点越高,则从上到下对应单质的熔、沸点逐渐升高,故D正确;
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表的结构、元素的位置及性质为解答的关键,侧重分析与应用能力的考查,注意元素在自然界的存在,题目难度不大.

练习册系列答案
相关题目
10.下列过程中未发生氧化还原反应的是( )
| A. | 实验室用NH4Cl与NaNO2溶液混合微热制N2 | |
| B. | SnCl4与水的反应:SnCl4+2H2O═SnO2+4HCl | |
| C. | 人工树叶制取甲烷:CO2+2H2O$\frac{\underline{\;\;\;\;\;\;\;光\;\;\;\;\;\;\;}}{人工树叶}$CH4+2O2 | |
| D. | 银针验毒:4Ag+2H2S+O2═2Ag2S+2H2O |
1.某无色透明溶液中可能含有以下离子中的若干种K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、CO32-、I-和Cl-,取该溶液进行如下实验:
①溶液滴在pH试纸上,呈红色
②将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色
③取少许溶液滴入BaCl2溶液,则产生白色沉淀
④取实验③中的澄清溶液,滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断原溶液中( )
①溶液滴在pH试纸上,呈红色
②将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色
③取少许溶液滴入BaCl2溶液,则产生白色沉淀
④取实验③中的澄清溶液,滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断原溶液中( )
| A. | ②中无色气体中有NO,可能含CO2 | |
| B. | ③中沉淀有BaSO4,可能含BaCO3 | |
| C. | 肯定存在的离子是Al3+、SO42-、NO3-、Mg2+,肯定不存在的离子是Ba2+、Fe2+、CO32-、I-,不能确定的离子是K+、Cl- | |
| D. | ②中红棕色气体通入水中发生反应的离子方程式为:3NO2+H2O═H++NO3-+2NO |
8.下列有关有机物研究方法的说法中,不正确的是( )
| A. | 应用李比希法、钠熔法、铜丝燃烧法、元素分析仪都可确定有机化合物的元素组成 | |
| B. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物组成元素和结构的分析 | |
| C. | 运用同位素示踪法可确定有机物的反应机理 | |
| D. | 可用酸性高锰酸钾溶液或溴水鉴定某有机物分子中是否含有碳碳双键 |
5.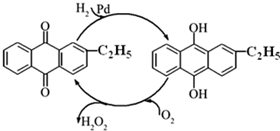 过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是过氧化氢具有强氧化性.
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用图表示,此过程中与Pd起相同作用的物质为乙基蒽醌 (写名称).
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中.
①实验I、Ⅱ研究对分解速率的影响,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为1.0moL•L-1.
②三组实验中分解速率最慢的是Ⅰ(填编号).
m.过氧化氢含量的实验测定
兴趣小组同学用0.1000moL•L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为 2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(4)滴定到达终点的现象是锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色.
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4 标准溶液体积如下表所示.
计算试样中过氧化氢的浓度为0.180 moL•L-1 (保留三位有效数字).
 过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是过氧化氢具有强氧化性.
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用图表示,此过程中与Pd起相同作用的物质为乙基蒽醌 (写名称).
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中.
| 实验编号 | T/X | H2O2初始浓度/moL•L-1 | FeCl3初始浓度/moL•L-1 |
| I | 20 | 1.0 | 0 |
| n | 50 | 1.0 | 0 |
| in | 50 | 1.0 | 0.1 |
②三组实验中分解速率最慢的是Ⅰ(填编号).
m.过氧化氢含量的实验测定
兴趣小组同学用0.1000moL•L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为 2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(4)滴定到达终点的现象是锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色.
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4 标准溶液体积如下表所示.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
6.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 ,又知乙与DB2可进行反应,写出相应的化学方程式Na2O2+SO2=Na2SO4.
,又知乙与DB2可进行反应,写出相应的化学方程式Na2O2+SO2=Na2SO4. .
.