题目内容
10.下列过程中未发生氧化还原反应的是( )| A. | 实验室用NH4Cl与NaNO2溶液混合微热制N2 | |
| B. | SnCl4与水的反应:SnCl4+2H2O═SnO2+4HCl | |
| C. | 人工树叶制取甲烷:CO2+2H2O$\frac{\underline{\;\;\;\;\;\;\;光\;\;\;\;\;\;\;}}{人工树叶}$CH4+2O2 | |
| D. | 银针验毒:4Ag+2H2S+O2═2Ag2S+2H2O |
分析 氧化还原反应的特征是化合价的升降,可根据元素的化合价是否有变化来判断有无氧化还原反应发生.
解答 解:A.实验室用NH4Cl与NaNO2溶液混合微热制N2中,N元素的化合价发生变化,属于氧化还原反应,故A不选;
B.SnCl4+2H2O═SnO2+4HCl为复分解反应,各元素的化合价没有发生变化,故B选;
C.CO2+2H2O$\frac{\underline{\;\;\;\;\;\;\;光\;\;\;\;\;\;\;}}{人工树叶}$CH4+2O2中C、O元素的化合价发生变化,属于氧化还原反应,故C不选;
D.反应4Ag+2H2S+O2═2Ag2S+2H2O中Ag、O元素的化合价发生变化,属于氧化还原反应,故D不选;
故选B.
点评 本题考查氧化还原反应,题目难度不大,明确氧化还原反应的实质、特征为解答关键,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
20.2007年6月5日各大媒体报道了中国在南海北部成功钻获天然气水合物实物样品“可燃冰”,从而成为继美国、日本、印度之后第4个通过国家级研发计划采到水合物实物样品的国家.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.关于“可燃冰”的叙述不正确的是( )
| A. | “可燃冰”有可能成为人类未来的重要能源 | |
| B. | “可燃冰”是一种比较洁净的能源 | |
| C. | “可燃冰”提供了水可能变成油的例证 | |
| D. | “可燃冰”的主要可燃成份是甲烷 |
1.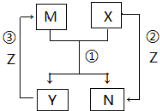 X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列说法错误的是( )
X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列说法错误的是( )
 X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列说法错误的是( )
X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列说法错误的是( )| A. | 该过程所涉及的反应均为氧化还原反应 | |
| B. | 当X单质为金属时,可能是Na或Fe | |
| C. | 当X单质为非金属时,X可以是 碳 | |
| D. | 反应①一定是氧化还原反应 |
5.氯气是有毒的,曾被德国法西斯制成毒气弹用于侵略战争.当这种毒气弹顺风爆炸时,通常可选用的防御方法是( )
①人躲到低洼的地方
②人躲到较高的地方
③用浸有氢氧化钠浓溶液的毛巾蒙面
④用浸有肥皂水的软布蒙面.
①人躲到低洼的地方
②人躲到较高的地方
③用浸有氢氧化钠浓溶液的毛巾蒙面
④用浸有肥皂水的软布蒙面.
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ②③④ |
15.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应生成的气体Y同时通入盛有足量BaCl2溶液的洗气瓶,下列有关说法不正确的是( )
| A. | 洗气瓶中产生的沉淀是BaCO3 | B. | 最终导出的气体中有CO2 | ||
| C. | 洗气瓶中产生的沉淀是BaSO4 | D. | 最终导出的气体可能是红棕色的 |
2.国际化学命名委员会在1978年作出决定.把周期表原先的主、副族及族号取消,由左到右改为第1~18列.碱金属族为第1列,稀有气体为第18列,按规定下列说法正确的是( )
| A. | 第1列和第2列元素都是金属元素 | |
| B. | 只有第2列元素原子的最外层是2个电子 | |
| C. | 第16列和第17列元素都只能以化合态存在于自然界中 | |
| D. | 第17列元素的单质熔、沸点逐渐升高 |
14.向某溶液中加入稀HNO3酸化的BaCl2溶液,有白色沉淀产生.该溶液含有( )
| A. | CO32- | B. | OH- | C. | SO42- | D. | HCO3- |
