题目内容
12.现有A、B、C、D四种短周期元素,其原子序数依次增大.已知A、C位于同一主 族、A在周期表中原子半径最小、B、D的最外层电子数相等、且B、D能形成DB2和DB3两种 化合物.请回答下列问题:(1)写出由A、B、C、D四种元素中的两种元素组成、且具有漂白作用的三种物质的化学式SO2、H2O2、Na2O2.
(2)C与D能形成化合物甲,写出化合物甲与稀盐酸的反应方程式Na2S+2HCl=H2S↑+2NaCl.
(3)仅由B、C形成的一种化合物乙常做供氧剂,写出乙的电子式
 ,又知乙与DB2可进行反应,写出相应的化学方程式Na2O2+SO2=Na2SO4.
,又知乙与DB2可进行反应,写出相应的化学方程式Na2O2+SO2=Na2SO4.(4)已知元素E比B元素的原子序数小1,则E元素的最高价含氧酸的稀溶液与铜反应的离子方程式为Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O.
分析 A、B、C、D四种短周期元素,其原子序数依次增大.已知A、C位于同一主族、A在周期表中原子半径最小,则A为H,C为Na;B、D的最外层电子数相等、且B、D能形成DB2和DB3两种化合物,则B为O,D为S,形成两种化合物为SO2和SO3,
(1)二氧化硫及具有强氧化性的物质具有漂白性;
(2)硫化钠与盐酸反应生成氯化钠和硫化氢;
(3)仅由B、C形成的一种化合物乙常做供氧剂,乙为过氧化钠,与二氧化硫发生氧化还原反应生成硫酸钠;
(4)元素E比B元素的原子序数小1,E为N,E元素的最高价含氧酸的稀溶液为稀硝酸,与铜反应生成硝酸铜、NO和水.
解答 解:A、B、C、D四种短周期元素,其原子序数依次增大.已知A、C位于同一主族、A在周期表中原子半径最小,则A为H,C为Na;B、D的最外层电子数相等、且B、D能形成DB2和DB3两种化合物,则B为O,D为S,形成两种化合物为SO2和SO3,
(1)二氧化硫及具有强氧化性的物质具有漂白性,则由A、B、C、D四种元素中的两种元素组成、且具有漂白作用的三种物质的化学式为SO2、H2O2、Na2O2,
故答案为:SO2;H2O2;Na2O2;
(2)硫化钠与盐酸反应生成氯化钠和硫化氢,反应方程式为Na2S+2HCl=H2S↑+2NaCl,故答案为:Na2S+2HCl=H2S↑+2NaCl;
(3)仅由B、C形成的一种化合物乙常做供氧剂,乙为过氧化钠,其电子式为 ,与二氧化硫发生氧化还原反应生成硫酸钠,反应为Na2O2+SO2=Na2SO4,故答案为:
,与二氧化硫发生氧化还原反应生成硫酸钠,反应为Na2O2+SO2=Na2SO4,故答案为: ;Na2O2+SO2=Na2SO4;
;Na2O2+SO2=Na2SO4;
(4)元素E比B元素的原子序数小1,E为N,E元素的最高价含氧酸的稀溶液为稀硝酸,与铜反应生成硝酸铜、NO和水,离子反应为Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,故答案为:Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、原子结构、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(4s)>E(3d) | D. | E(5s)>E(4s)>E(4f) |
| A. | “可燃冰”有可能成为人类未来的重要能源 | |
| B. | “可燃冰”是一种比较洁净的能源 | |
| C. | “可燃冰”提供了水可能变成油的例证 | |
| D. | “可燃冰”的主要可燃成份是甲烷 |
| A. | 单质易溶于水 | B. | 最高价氧化物对应水化物是酸 | ||
| C. | 单质既有氧化性又有还原性 | D. | 气态氢化物的稳定性较H2S弱 |
 X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列说法错误的是( )
X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列说法错误的是( )| A. | 该过程所涉及的反应均为氧化还原反应 | |
| B. | 当X单质为金属时,可能是Na或Fe | |
| C. | 当X单质为非金属时,X可以是 碳 | |
| D. | 反应①一定是氧化还原反应 |
| A. | 第1列和第2列元素都是金属元素 | |
| B. | 只有第2列元素原子的最外层是2个电子 | |
| C. | 第16列和第17列元素都只能以化合态存在于自然界中 | |
| D. | 第17列元素的单质熔、沸点逐渐升高 |

 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$ 

 I:
I: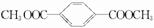 .
. +3H2$→_{△}^{催化剂}$
+3H2$→_{△}^{催化剂}$ ;反应⑥CH2Br-CH2Br+2H2O$→_{△}^{NaOH}$CH2OH-CH2OH+2HBr.
;反应⑥CH2Br-CH2Br+2H2O$→_{△}^{NaOH}$CH2OH-CH2OH+2HBr.