题目内容
18.已知阿伏加德罗常数NA,下列说法正确的是( )| A. | 16g CH4中含有4NA个原子 | |
| B. | 1mol/L NaCl溶液含有NA个Na+ | |
| C. | 1mol Al和足量稀盐酸反应转移3NA个电子 | |
| D. | 标准状况下,22.4L CCl4中含有4NA个氯原子 |
分析 A、求出甲烷的物质的量,然后根据1mol甲烷中含5mol原子来分析;
B、溶液体积不明确;
C、铝和盐酸反应后变为+3价;
D、标况下四氯化碳为液体.
解答 解:A、16g甲烷的物质的量为1mol,而1mol甲烷中含5mol原子,即5NA个,故A错误;
B、溶液体积不明确,故溶液中的钠离子的个数无法计算,故B错误;
C、铝和盐酸反应后变为+3价,故1mol铝反应后转移3mol电子即3NA个,故C正确;
D、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
9.下列物质中,既含有共价键又含有离子键的是( )
| A. | HCl | B. | Na2S | C. | MgCl2 | D. | NaOH |
3.能用CO32-+2H+═H2O+CO2↑离子方程式表示的反应是( )
| A. | (NH4)2CO3+H2SO4═(NH4)2SO4+H2O+CO2↑ | |
| B. | NaHCO3+HNO3═NaNO3+H2O+CO2↑ | |
| C. | Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑ | |
| D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
10.下列离子方程式书写正确的是( )
| A. | 硫化亚铁溶于足量稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O | |
| C. | FeCl2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
8.相同状况下,将分别盛满如下体积比的混合气体的四支相同的试管倒立于水槽中,最后试管内液面上升的高度最高的是( )
| A. | V(NO2):V(O2)=2:1 | B. | V(NO):V(O2)=2:1 | ||
| C. | V(NH3):V(O2)=2:1 | D. | V(NO2):V(NO):V(O2)=1:1:1 |

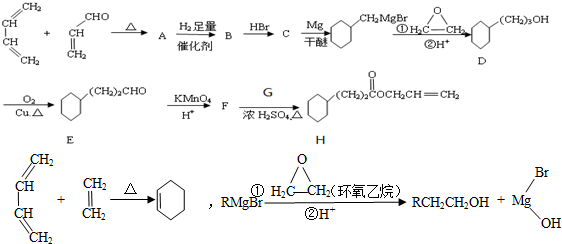
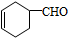 ,G物质核磁共振氢谱共有4个峰.
,G物质核磁共振氢谱共有4个峰. .写出D生成E的化学方程式
.写出D生成E的化学方程式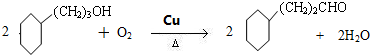 .
.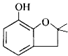 呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式:
呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式: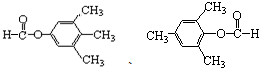 .
.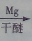 CH3CH2MgBr
CH3CH2MgBr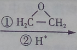 CH3CH2CH2CH2OH.
CH3CH2CH2CH2OH.