题目内容
8.某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池负极的电极反应为CH3OH+8OH--6e-=CO32-+6H2O.
②工作一段时间后,测得溶液的pH减小填(增大、不变、减小).
③用该电池作电源,组成如图所示装置(a、b、c、d均为石墨电极),甲容器装250mL0.04mol/L CuSO4溶液,乙容器装400mL饱和NaCl溶液,写出c电极的电极反应式2Cl--2e-=Cl2↑,常温下,当400mL乙溶液的pH为13时,断开电源,则在甲醇电池中消耗O2的体积为224mL(标准状况),电解后向甲中加入适量下列某一种物质,可以使溶液恢复到原来状态,该物质是CD (填写编号).
A.CuO B.CuCO3 C.Cu(OH)2 D.Cu2(OH)2CO3.
分析 ①在燃料电池中,负极是燃料发生失电子的氧化反应,即CH3OH+8OH--6e-=CO32-+6H2O;
②CH3OH+8OH--6e-=CO32-+6H2O,氢氧根离子被消耗;
③c电极上氯离子放电生成氯气;根据转移电子相等计算消耗氧气体积;根据“析出什么加入什么”的原则确定加入物质.
解答 解:①在燃料电池中,负极是燃料发生失电子的氧化反应,即CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
②CH3OH+8OH--6e-=CO32-+6H2O,氢氧根离子被消耗,所以溶液的pH减小,故答案为:减小;
③c电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,乙中电池反应式为2NaCl+2H2O=2NaOH+Cl2↑+H2↑,溶液中生成n(NaOH)=0.1mol/L×0.4L=0.04mol,转移电子的物质的量=0.04mol,串联电路中转移电子相等,所以消耗氧气体积=$\frac{0.04}{4}×22.4$=224mL;甲中阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成铜,
n(CuSO4)=0.25L×0.04mol/L=0.01mol,铜离子完全放电时转移电子0.02mol<0.04mol,所以阴极上还有部分氢气生成,所以相当于析出CuO和水,可以加入CD使溶液恢复原状,故选CD,
故答案为:2Cl--2e-=Cl2↑;224;CD.
点评 本题考查较综合,根据盖斯定律、原电池和电解池原理来分析解答即可,注意(3)③中阴极上生成的物质,为易错点.

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
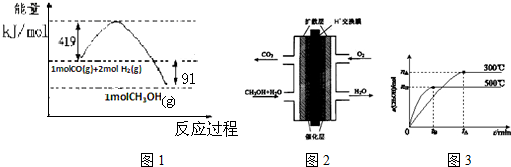
18.I.甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇CO(g)+2H2(g)?CH3OH(g)
已知①常压下反应的能量变化如图1所示:
②有关键能的数据
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-280kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
H2O(l)═H2O(g)△H=+44kJ/mol
请回答下列问题
(1)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1
(2)在低温情况下有利于一氧化碳和氢气制备甲醇的反应自发进行(填“高温”或“低温”),H-O的键能数据x的值为462
(3)甲醇燃料电池的结构示意图如图2.甲醇进入负极极(填“正”或“负”),正极发生的电极反应为O2+4e-+4H+=2H2O.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(4)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;根据图3,升高温度,K值将减小(填“增大”、“减小”或“不变”).
(5)判断该可逆反应达到化学平衡状态的标志是cdf(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化.
已知①常压下反应的能量变化如图1所示:

②有关键能的数据
| 化学键 | H-H | H-O | O=O |
| 键能KJ/mol | 436 | x | 496 |
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
H2O(l)═H2O(g)△H=+44kJ/mol
请回答下列问题
(1)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1
(2)在低温情况下有利于一氧化碳和氢气制备甲醇的反应自发进行(填“高温”或“低温”),H-O的键能数据x的值为462
(3)甲醇燃料电池的结构示意图如图2.甲醇进入负极极(填“正”或“负”),正极发生的电极反应为O2+4e-+4H+=2H2O.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(4)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;根据图3,升高温度,K值将减小(填“增大”、“减小”或“不变”).
(5)判断该可逆反应达到化学平衡状态的标志是cdf(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化.
19.不能用胶体有关知识解释的现象是( )
| A. | 将盐卤或石膏加入豆浆中制豆腐 | |
| B. | 钢笔同时使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 向氯化铁溶液中加入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
16.将金属A和金属B分别放入稀H2SO4中均有氢气生成.若将金属A和金属B相连后投入稀H2SO4中发现A被腐蚀;B未被腐蚀.关于B的叙述正确的是( )
| A. | 金属活动性B>A | |
| B. | 还原性B>A | |
| C. | 在后者装置中金属A发生还原反应,金属B发生氧化反应 | |
| D. | 金属B的表面上明显有气泡产生,金属A表面无气泡 |
3.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、C1-)生产CuCl的流程如下:

根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是接触室,现代氯碱工业的装置名称是离子交换膜电解槽;
(2)写出生产过程中XFe YHCl (填化学式)
(3)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4
(4)生产中为了提髙CuCl产品的质量,采用抽滤或者减压过滤_法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少产品CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解.
(5)在CuCl的生成过程中理论上不需要补充S02气体,其理由是Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放人玻璃珠50粒和10mL过量的FeCl3溶液 250mL锥形瓶中,不断摇动;
②待样品溶解后加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.已知:CuCl+FeCl3═CuCl2+FeCl2 Fe2++Ce4+═Fe3++Ce3+如此再重复二次测得
④数据处理:计算得该工业CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)

根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是接触室,现代氯碱工业的装置名称是离子交换膜电解槽;
(2)写出生产过程中XFe YHCl (填化学式)
(3)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4
(4)生产中为了提髙CuCl产品的质量,采用抽滤或者减压过滤_法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少产品CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解.
(5)在CuCl的生成过程中理论上不需要补充S02气体,其理由是Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放人玻璃珠50粒和10mL过量的FeCl3溶液 250mL锥形瓶中,不断摇动;
②待样品溶解后加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.已知:CuCl+FeCl3═CuCl2+FeCl2 Fe2++Ce4+═Fe3++Ce3+如此再重复二次测得
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 24.65 | 24.75 | 24.70 |
13.下列离子方程式正确的是( )
| A. | 氢氧化铜与硫酸溶液反应 OH-+H+═H2O | |
| B. | 铁与稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 铁和硫酸铜溶液反应 Fe+Cu2+═Cu+Fe2+ | |
| D. | 碳酸钙与盐酸溶液反应 CO32-+2H+═H2O+CO2↑ |
20.下列有关化学用语表示正确的是( )
| A. | 乙烯的最简式:CH2=CH2; 对甲基苯甲醇的结构简式: | |
| B. | Cl-的结构示意图: 甲烷分子的球棍模型: 甲烷分子的球棍模型: | |
| C. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ | |
| D. | 羟基的电子式: 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl |
17.金属及其化合物转化关系是化学学习的重要内容之一.下列各组物质的转化关系,不全部是通过一步反应完成的是( )
| A. | Na→NaOH→Na2CO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Mg→MgCl2→Mg(OH)2→MgSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
18.已知阿伏加德罗常数NA,下列说法正确的是( )
| A. | 16g CH4中含有4NA个原子 | |
| B. | 1mol/L NaCl溶液含有NA个Na+ | |
| C. | 1mol Al和足量稀盐酸反应转移3NA个电子 | |
| D. | 标准状况下,22.4L CCl4中含有4NA个氯原子 |