题目内容
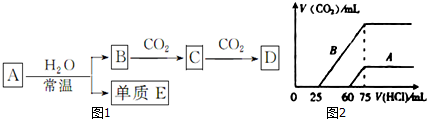
13.某学习小组在学习了金属的知识后,探究Cu的常见化合物的性质.【提出问题】
①Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③CuO能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、H2SO4(HCl)溶液(1分)、NaOH溶液.
同时进行相关实验.
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量,A的质量为72g,A的化学式为Cu2O;.向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在.写出A与稀硫酸反应的化学方程式Cu2O+H2SO4=Cu+CuSO4+H2O.
(3)为解决问题③,设计的实验装置为(夹持装置未画出):
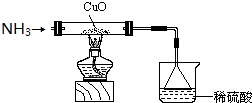
实验中观察到CuO变为红色物质.查资料可知,反应产物中还有一种无污染的气体.该气体的化学式为N2.
【实验结论】
(1)Cu(OH)2具有两性.
证明Cu(OH)2具有酸性的化学反应是Cu(OH)2+2NaOH═Na2[Cu(OH)4],写出该反应的离子方程式Cu(OH)2+2OH-=Cu(OH)42-.
(2)根据实验方案(2),得出的+1价Cu和+2价Cu稳定性大小的结论是高温时Cu+稳定性大于Cu2+;在酸性溶液中Cu2+稳定性大于Cu+.
(3)CuO能够被NH3还原.
【问题讨论】
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物.请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?
分析 【实验方案】
(1)要证明Cu(OH)2具有两性,应先加入碱生成Cu(OH)2,即与酸或碱都能反应,据此判断所需要的试剂;
(2)根据质量守恒计算中含有1molCu,质量为64g,剩余为O元素;依据反应现象书写离子方程式;
(3)根据反应遵循质量守恒定律和该气体物污染确定气体的化学式;
【实验结论】
(1)根据Cu(OH)2不溶于水,Na2[Cu(OH)4]、NaOH都是可溶的强电解质,结合离子方程式的书写规则书写离子方程式;
(2)根据在不同温度下反应物的组成可确定物质的稳定性;
【问题讨论】
A为Cu2O,在酸性条件下不稳定,可加入酸进行检验.
解答 解:【实验方案】(1)要证明Cu(OH)2具有两性,应先加入碱生成Cu(OH)2,然后在氢氧化铜中加入硫酸或盐酸以及氢氧化钠,观察其是否能反应,所以需要的试剂是H2SO4(HCl)溶液、NaOH溶液,
故答案为:H2SO4(HCl)溶液、NaOH溶液;
(2)98g Cu(OH)2固体的物质的量为1mol,解热分解生成的72g固体中含有Cu的质量为1mol,即64g,则氧原子的质量为72g-64g8g,n(O)=$\frac{8g}{16g/mol}$=0.5mol,
则A中n(Cu):n(O)=2:1,向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,说明生成了铜和铜离子,反应的化学方程式为:Cu2O+H2SO4=Cu+CuSO4+H2O,
故答案为:Cu2O; Cu2O+H2SO4=Cu+CuSO4+H2O;
(3)氧化铜和氨气反应生成红色物质铜,根据反应遵循质量守恒定律和该气体无污染确定气体为氮气,故答案为:N2;
【实验结论】
(1)根据Cu(OH)2不溶于水,Na2[Cu(OH)4]、NaOH都是可溶的强电解质,反应的离子方程式为Cu(OH)2+2OH-=Cu(OH)42-,
故答案为:Cu(OH)2+2OH-=Cu(OH)42-;
(2)80℃~100℃时,得到黑色固体粉末,为CuO,继续加热到1000℃以上,黑色粉末全部变成红色粉末,说明在较高温度时Cu2O稳定,与酸反应生成硫酸铜和铜,说明在酸性条件下+2价的铜稳定,
故答案为:Cu+稳定性大于Cu2+;Cu2+稳定性大于Cu+;
【问题讨论】
如含有Cu2O,根据其与酸反应的现象可判断,方程式为:Cu2O+H2SO4═Cu+CuSO4+H2O,溶液变蓝,而铜与稀硫酸不反应,
答:取样,加入稀硫酸,如果得到蓝色溶液和红色固体,说明有A; 如果不溶解,说明无A.
点评 本题考查实验探究和数据处理,做题时注意两性氢氧化物的性质以及质量守恒定律计算物质的化学式,本题有一定难度.


根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是接触室,现代氯碱工业的装置名称是离子交换膜电解槽;
(2)写出生产过程中XFe YHCl (填化学式)
(3)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4
(4)生产中为了提髙CuCl产品的质量,采用抽滤或者减压过滤_法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少产品CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解.
(5)在CuCl的生成过程中理论上不需要补充S02气体,其理由是Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放人玻璃珠50粒和10mL过量的FeCl3溶液 250mL锥形瓶中,不断摇动;
②待样品溶解后加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.已知:CuCl+FeCl3═CuCl2+FeCl2 Fe2++Ce4+═Fe3++Ce3+如此再重复二次测得
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 24.65 | 24.75 | 24.70 |
| A. | 锌粒与醋酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | 铁粉与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 常温下氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| A. | 3Br2+6KOH═5KBr+KBrO3+3H2O | |
| B. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+2H2O+Cl2↑ | |
| C. | 2KNO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2KNO2+O2↑ | |
| D. | NH4NO3 $\frac{\underline{\;\;△\;\;}}{\;}$ N2O↑+2H2O |
| A. | 16g CH4中含有4NA个原子 | |
| B. | 1mol/L NaCl溶液含有NA个Na+ | |
| C. | 1mol Al和足量稀盐酸反应转移3NA个电子 | |
| D. | 标准状况下,22.4L CCl4中含有4NA个氯原子 |
| A. | 石墨与O2反应 | B. | 硫磺与O2反应 | ||
| C. | 闪电时,氮气与O2反应 | D. | 硅在足量的O2中燃烧 |
 扁桃酸是重要的医药和染料中间体,其应用非常广泛.扁桃酸的结构简式如图所示.
扁桃酸是重要的医药和染料中间体,其应用非常广泛.扁桃酸的结构简式如图所示.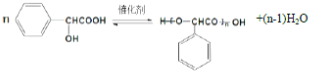 .
. .
.