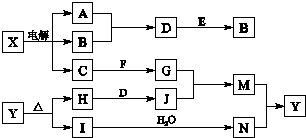
题目内容
4.下列反应 不属于取代反应的是( )| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. | CH2═CH2+HBr-→CH3-CH2Br | |
| C. | CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | 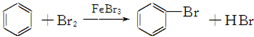 |
分析 当有机化合物分子里的某些原子或原子团被其它原子或原子团所代替时,该反应为取代反应,发生取代反应时,C=C、C=O、C≡C不发生变化,以此解答该题.
解答 解:A.甲烷与氯气在光照条件下,甲烷分子中的H原子被Cl原子取代生成一氯甲烷,属于取代反应,故A不选;
B.乙烯与HBr发生反应生成溴乙烷,碳碳双键变成碳碳单键,为加成反应,故B选;
C.乙酸→乙酸乙酯,乙酸与乙醇发生酯化反应生成乙酸乙酯,该反应为取代反应,故C不选;
D.苯与溴反应生成溴苯,氢原子被溴原子取代,为取代反应,故D不选.
故选B.
点评 本题考查有机物的结构和性质,侧重于有机物的性质与反应类型的判断,题目难度不大,注意掌握常见有机反应类型,明确取代反应与其它反应类型的区别,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
14.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其是在寒冷的季节易诱发关节疼痛,其化学机理为:①HUr+H2O?$U{r^-}+{H_3}{O^+}$②Ur-(aq)+Na+(aq)?NaUr(s)
下列对反应②的叙述正确的是( )
下列对反应②的叙述正确的是( )
| A. | 反应的△H>0 | B. | 反应的△H<0 | ||
| C. | 升高温度平衡向正反应方向移动 | D. | 降低温度平衡向正反应方向移动 |
15. 某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
 某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )| A. | 能与Br2发生加成反应 | B. | 能发生酯化反应 | ||
| C. | 能发生水解反应 | D. | 分子中有7个手性碳原子 |
19.直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:2SO2+O2+2H2O=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是SO2+2OH-=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①由表判断,NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-存在:HSO3-?SO32-+H+和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012•福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事实是C(填序号).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:2SO2+O2+2H2O=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是SO2+2OH-=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012•福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事实是C(填序号).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去.
9.元素X的原子有3个电子层,最外层有4个电子.这种元素位于周期表的( )
| A. | 第4周期ⅢA族 | B. | 第4周期ⅦA族 | C. | 第3周期Ⅳ族 | D. | 第3周期ⅣA族 |
13.元素X、Y、Z、W的原子序数依次增大,且原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足相应稳定结构.下列说法正确的是( )
| A. | X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X | |
| B. | 在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等 | |
| C. | 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 | |
| D. | X、Y、Z、W四种元素可形成化学式为Y2X5ZW2的化合物 |
14.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | B. | 气态氢化物稳定性为:ZH3>H2Y>HX | ||
| C. | 非金属性:X>Y>Z | D. | 原子半径:X>Y>Z |