题目内容
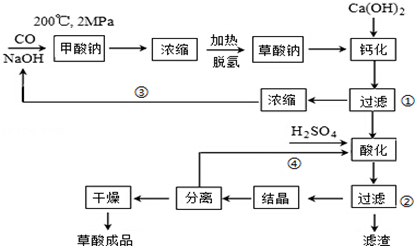
9. 用图中的实验装置制取乙炔.
用图中的实验装置制取乙炔.(1)实验中,调节A管高低的作用是调节水面的高度来控制反应的发生和停止;制取乙炔的化学方程式是CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)实验中所用电石不纯,会导致制得的乙炔气体中含有H2S等杂质,不仅使乙炔有特殊难闻的臭味,而且会干扰乙炔的检验.因此用酸性KMnO4溶液检验乙炔之前必须用CuSO4溶液或NaOH溶液除去其中的H2S杂质,乙炔通入酸性KMnO4酸性溶液中,现象是紫色酸性高锰酸钾溶液逐渐褪色,发生反应的反应类型是氧化反应;
(3)乙炔通入溴的CCl4溶液中观察到的现象是溶液褪色该反应的化学方程式为CH≡CH+2Br2→CHBr2CHBr2;
(4)一种与乙炔具有相同最简式的有机物立方烷,其结构简式为
 .
.①其分子式为C8H8,
②该化合物分子的一氯代物有种1同分异构体,二氯代物有种3同分异构体.
分析 (1)通过图中A管,可以控制反应的开始和停止;
(2)乙炔种含有硫化氢,可用硫酸铜或氢氧化钠溶液除杂,乙炔能含有不饱和键,能够使酸性高锰酸钾溶液褪色,发生氧化反应;
(3)乙炔分子中含有不饱和的碳碳三键,能够与溴发生加成反应;
(4) 的分子式为C8H8,有1种等效H,二氯代物有一条棱、面对角线、体对角线上3种位置.
的分子式为C8H8,有1种等效H,二氯代物有一条棱、面对角线、体对角线上3种位置.
解答 解:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,制取乙炔的化学方程式是CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:调节水面的高度来控制反应的发生和停止; CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔种含有硫化氢,可用硫酸铜或氢氧化钠溶液除杂,由于乙炔能含有不饱和键,能够使酸性高锰酸钾溶液褪色,发生氧化反应,
故答案为:CuSO4溶液或NaOH溶液;紫色酸性高锰酸钾溶液逐渐褪色;氧化反应;
(3)由于乙炔分子中含有不饱和的碳碳三键,能够与溴发生加成反应,方程式为CH≡CH+2Br2→CHBr2CHBr2,
故答案为:溶液褪色;CH≡CH+2Br2→CHBr2CHBr2;
(4)① 的分子式为C8H8,故答案为:C8H8;
的分子式为C8H8,故答案为:C8H8;
②有1种等效H,二氯代物有一条棱、面对角线、体对角线上3种位置,一氯代物有1种,二氯代物有3种,故答案为:1;3.
点评 本题考查乙炔的实验室制法,为高频考点,侧重于学生的分析、实验能力的考查,注意乙炔的结构和化学性质是解题的关键,本题侧重基础知识的考查,难度中等.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
17.生活中常用到一些化学知识,下列说法中不正确的是( )
| A. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| B. | 红葡萄酒营养丰富(含葡萄糖、维生素C等),常添加微量的二氧化硫,利用二氧化硫还原性,防止红葡萄酒中某营养成分被氧化 | |
| C. | 某雨水放置一段时间后pH由4.68变为4.28,因为水中亚硫酸被空气中氧气氧化成硫酸 | |
| D. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水 |
17.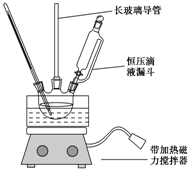 硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:
硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:
①取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,加入恒压滴液漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50~60℃下发生反应,直至反应结束.
④分离出产物后,依次用蒸馏水和100mL 0.1mol/L的Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
⑤向粗产品加入固体D除去水,然后蒸馏,得到纯净的硝基苯.
可能用到的有关数据列表如下
(1)写出该反应的化学方程式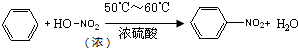 .
.
(2)配制混酸应在烧杯中先加入浓硝酸,长玻璃管作用是冷凝回流,恒压滴液漏斗的优点是使混合酸能顺利流下.
(3)反应温度控制在50~60℃的原因是防止副反应发生,反应结束后产物在下层(填“上”或者“下”),分离混酸和产品的操作名称是分液.
(4)实验前要配制100mL 0.1mol/L的Na2CO3溶液,需要用到的玻璃仪器除了玻璃棒、烧杯还有100ml容量瓶、胶头滴管.
(5)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)固体D的名称为无水氯化钙.
 硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:
硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:①取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,加入恒压滴液漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50~60℃下发生反应,直至反应结束.
④分离出产物后,依次用蒸馏水和100mL 0.1mol/L的Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
⑤向粗产品加入固体D除去水,然后蒸馏,得到纯净的硝基苯.
可能用到的有关数据列表如下
| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
 .
.(2)配制混酸应在烧杯中先加入浓硝酸,长玻璃管作用是冷凝回流,恒压滴液漏斗的优点是使混合酸能顺利流下.
(3)反应温度控制在50~60℃的原因是防止副反应发生,反应结束后产物在下层(填“上”或者“下”),分离混酸和产品的操作名称是分液.
(4)实验前要配制100mL 0.1mol/L的Na2CO3溶液,需要用到的玻璃仪器除了玻璃棒、烧杯还有100ml容量瓶、胶头滴管.
(5)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)固体D的名称为无水氯化钙.
14.用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4•H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是SiO2.
(2)将MnO2氧化Fe2+的离子方程式补充完整:
1MnO2+2Fe2++4H+=1 Mn2++2Fe3++2H2O
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、不会引入Cl-,使制得的MnSO4?H2O产品更纯净.
(4)已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是4.7≤a<7.6.
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4-与Mn2+反应生成MnO2.取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为$\frac{1.5y×1{0}^{-4}×55}{x}$.
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是SiO2.
(2)将MnO2氧化Fe2+的离子方程式补充完整:
1MnO2+2Fe2++4H+=1 Mn2++2Fe3++2H2O
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、不会引入Cl-,使制得的MnSO4?H2O产品更纯净.
(4)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
步骤Ⅲ中a的取值范围是4.7≤a<7.6.
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4-与Mn2+反应生成MnO2.取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为$\frac{1.5y×1{0}^{-4}×55}{x}$.
1.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,工业上用w kg难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg)的过程为:
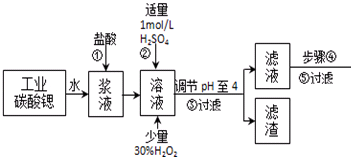
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
(1)操作①加快反应速率的措施有加热、充分搅拌、适当增加盐酸浓度等 (写一种).操作①中盐酸能否改用硫酸,其理由是:不能,否则会大量生成硫酸锶的沉淀,减少产物生物
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.

已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.
18.25℃时,下列有关溶液的说法正确的是( )
| A. | 难溶电解质Ag2SO4的饱和溶液中,若c(SO42-)=amol•L-1,则Ksp(Ag2SO4)=2a3 | |
| B. | 某氨水的pH=11,将此溶液稀释10倍后,溶液的pH<10 | |
| C. | Ka(HCN)<Ka(CH3COOH),说明相同温度下同浓度的HCN溶液的酸性比CH3COOH溶液的强 | |
| D. | pH=8的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-) |
19.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
 如图是一个电化学过程示意图.
如图是一个电化学过程示意图.