题目内容
3.钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag-\;}}{\;}$2MnO4-+10SO42-+16H+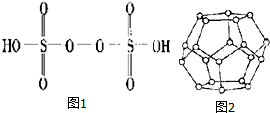
(1)基态锰原子的核外价电子排布式为3d54s2
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为O>S(填元素符号).
(3)已知H2S2O8的结构如图1.
①H2S2O8硫原子的轨道杂化方式为sp3杂化.
②上述反应每生成1mol MnO4-,S2O82-断裂的共价键类型为非极性键(填“极性键”、“非极性键”或“极性键和非极性键”),其数目为2.5NA.
(4)一定条件下,水分子间可通过O一H…O氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体
①如图2是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为30;
②实验测得冰中氢键的作用能为18.8kJ•mol-1,而冰的熔化热只有5.0kJ•mol-1,其原因可能是液态水中仍然存在大量氢键.
分析 (1)锰原子序数为25,根据构造原理写出其电子排布式;
(2)2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag-\;}}{\;}$2MnO4-+10SO42-+16H+中,涉及的元素属干同主族元素为O和S,同主族,自上而下第一电离能降低;
(3)①根据价层电子对=σ 键电子对+中心原子上的孤电子对,结合S2O8 2-结构判断杂化类型;
②活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键、同种非金属元素之间易形成非极性键,根据S2O8 2-结构分析解答;
(4)①由此结构可知,此单元中含有水分子的个数为:20,其中每个水分子属于三个五元环,据此计算氢键;
②冰中氢键的作用能为18.8kJ•mol-1,而冰熔化热为5.0kJ•mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且液态水中仍在氢键;
解答 解:(1)锰原子序数为25,质子数为25,原子核外电子数为25,根据能量最低原则,锰的电子排布式为:[Ar]3d54s2,价电子排布式为:3d54s2;
故答案为:3d54s2;
(2)同主族自上而下第一电离能减小,O、S同主族,所以第一电离能由大到小的顺序为:O>S;
故答案为:O>S;
(3)①H2S2O8中,硫原子价层电子对数=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$(6-4×1-2)=4,所以采取sp3杂化;
故答案为:sp3杂化;
②由反应可知,Mn元素的化合价升高(+2→+7),S元素的化合价降低(+7→+6),生成10molSO42-转移电子10mol电子,则每生成1molMnO4-,转移电子5mol电子,S2O8 2-断裂2.5mol(或2.5NA)O-O间非极性共价键;
故答案为:非极性键;2.5NA;
(4)①由此结构可知,此单元中含有水分子的个数为:20,其中每个水分子形成的氢键属于2个五元环,故每个水分子形成氢键个数为$\frac{3}{2}$,故总共形成氢键数为:20×$\frac{3}{2}$=30;
故答案为:30;
②冰中氢键的作用能为18.8kJ•mol-1,而冰熔化热为5.0kJ•mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且液态水中仍在氢键;
故答案为:液态水中仍然存在大量氢键;
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式、氢键等,是对学生综合能力的考查,难度中等.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | 碳酸钠溶液 | B. | 氯化钡溶液 | C. | 硝酸银溶液 | D. | 稀盐酸 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(1)A、D的元素名称:A钠、D氯;B形成的简单离子的结构示意图为

(2)写出C的最高价氧化物对应水化物可能的化学式H2SiO3或H2SO4.
| A. | 不慎打翻燃着的酒精灯,立即用湿抹布盖灭 | |
| B. | 金属钠着火时,立即用泡沫灭火器进行灭火 | |
| C. | 给盛有液体的试管加热时,要不断移动试管或加人碎瓷片 | |
| D. | 浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上硼酸溶液 |
| A. | 淀粉和纤维素在一定条件下均能水解 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物,有固定的熔点、沸点 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油,可以实现厨余废物合理利用 |

 在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分. 某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.请完成下列问题:
某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.请完成下列问题: