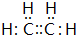题目内容
3.已知| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(1)A、D的元素名称:A钠、D氯;B形成的简单离子的结构示意图为

(2)写出C的最高价氧化物对应水化物可能的化学式H2SiO3或H2SO4.
分析 A、B、C、D为具有相同电子层数的四种主族元素,5.4gB单质与盐酸充分反应后可生成6.72LH2(标准状况),B为金属,设其相对分子质量为a,化合价为b,则$\frac{5.4}{a}$×b=$\frac{6.72}{22.4}$×2,整理可得a=9b,则b=3、a=27,B原子中子数比质子数多一个,则质子数为13,故B为Al,均为短周期元素,其中A的第一电离能最小,则A为Na,C的最外层轨道上有2个未成对电子,最外层电子数排布为3s23p2或3s23p4,故C为Si或S;D的电负性最大,则D为Cl,据此解答.
解答 解:A、B、C、D为具有相同电子层数的四种主族元素,5.4gB单质与盐酸充分反应后可生成6.72LH2(标准状况),B为金属,设其相对分子质量为a,化合价为b,则$\frac{5.4}{a}$×b=$\frac{6.72}{22.4}$×2,整理可得a=9b,则b=3、a=27,B原子中子数比质子数多一个,则质子数为13,故B为Al,均为短周期元素,其中A的第一电离能最小,则A为Na,C的最外层轨道上有2个未成对电子,最外层电子数排布为3s23p2或3s23p4,故C为Si或S;D的电负性最大,则D为Cl.
(1)A为钠元素,D为硫元素,B为Al,形成的简单离子的结构示意图为 ,
,
故答案为:钠;硫; ;
;
(2)C为Si或S,最高价氧化物对应水化物可能的化学式为H2SiO3或H2SO4,
故答案为:H2SiO3或H2SO4.
点评 本题考查结构性质位置关系应用,关键是计算确定B为Al,再结合元素周期律推断,难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
13.下列有关“化学与生活”描述不正确的是( )
| A. | 核能的利用可能会造成放射性污染,应该立即关闭所有核电站 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 泡沫灭火器中使用了盐类水解的原理 | |
| D. | 宁德新能源公司生产的锂离子电池可以将化学能转化为电能 |
14.下列无色透明水溶液中,能大量共存的一组离子是( )
| A. | K+、Mg2+、CO32-、Cl- | B. | Na+、Ba2+、HCO3-、OH- | ||
| C. | Mg2+、H+、Cl-、SO42- | D. | K+、SO42-、Cu2+、NO3- |
11.下列离子方程式书写正确的是( )
| A. | 稀硫酸与氢氧化钡溶液的反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 氢氧化铝与稀硝酸反应:Al(OH)3+3H+═Al3++3H2O | |
| D. | 钠与水反应:2Na+2H2O═2Na++OH-+H2↑ |
8.短周期元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,X原子核外M电子层的电子数为1,Y是地壳中含量最高的金属元素,Z的单质可用于自来水的杀菌消毒.根据以上叙述,下列说法中正确的是( )
| A. | 四种元素的原子半径大小为W<X<Y<Z | |
| B. | 元素W与氢形成的原子比为1:1的化合物只有2种 | |
| C. | X、Y、Z的最高价氧化对应的水化物能相互反应 | |
| D. | 由W和Z组成的物质在熔融时能导电 |
20.下列有关物质的性质或应用说法正确的是( )
| A. | 糖类、油脂、蛋白质在一定条件下均可以水解 | |
| B. | SiO2既能溶于NaOH溶液又能溶于HF,说明SiO2是两性氧化物 | |
| C. | 从海水中得到氯化镁晶体,电解氯化镁晶体可获得金属Mg | |
| D. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |
1.在密闭容器中的一定量的混合气体发生反应:xA(g)+yB(g)?zC(g),平衡时,测得A的浓度为0.50mol•L-1,在温度不变时,把容器容积缩小到原来的0.5倍,使其重新达到平衡,测得A的浓度为0.90mol•L-1.下列有关判断正确的是( )
| A. | x+y<z | B. | 平衡逆向移动 | C. | A的转化率降低 | D. | C的体积分数升高 |
 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空: