题目内容
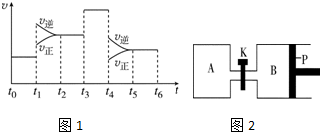
13. 某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.请完成下列问题:
某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.请完成下列问题:(1)请写出此电池的负极反应式:Mg-2e-=Mg2+
(2)电池工作时时,电子在外电路的流向为:从Mg经由导线流向Ag
(3)取出盐桥,电流表不偏转(“不”或者“会”)
(4)电路中每转移2mol电子,镁片的质量会减少(“增加”或者“减少”)24克.
(5)请设计试验装置使Ag与盐酸反应生成氢气.
分析 (1)Mg、Ag、硝酸银构成的原电池中,Mg失电子作负极;
(2)电子从负极流向正极;
(3)取出盐桥时不能形成闭合回路;
(4)根据电极反应中Mg与电子的关系计算Mg的质量;
(5)活性电极作阳极时,电极失电子生成金属阳离子,阴极上溶液中的阳离子得电子.
解答 解:(1)Mg、Ag、硝酸银构成的原电池中,Mg失电子作负极,负极反应为:Mg-2e-=Mg2+;
故答案为:Mg-2e-=Mg2+;
(2)原电池中,电子从负极流向正极,Mg为负极,Ag为正极,则电子从Mg经由导线流向Ag;
故答案为:从Mg经由导线流向Ag;
(3)取出盐桥时不能形成闭合回路,不满足原电池的构成条件,不能形成原电池,所以没有电流通过,电流表不偏转;
故答案为:不;
(4)Mg电极上的电极方程式为Mg-2e-=Mg2+,则电路中每转移2mol电子,消耗1molMg,即Mg减少的质量为24g;
故答案为:24;
(5)使Ag与盐酸反应生成氢气,需要把活性电极Ag作阳极,Ag失电子生成阴离子,石墨为阴极,阴极上溶液中的阳离子得电子,即氢离子得电子生成氢气,其电解总反应为:2Ag+2HCl=2AgCl+H2↑;
答:Ag作阳极,石墨为阴极,HCl溶液为电解质溶液,通电电解.
点评 本题考查原电池和电解池有关知识,侧重于学生分析能力和基本理论的理解和运用的考查,注意把握金属的活泼性强弱以及电极方程式的书写,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列说法不正确的是( )
| A. | C2H4Cl2有三种同分异构体 | |
| B. | 将苯与浓硝酸和浓硫酸共热制取硝基苯 | |
| C. | 将红热的铜丝迅速插入无水乙醇中可将乙醇氧化为乙醛 | |
| D. | 可用浓硝酸鉴别淀粉溶液和鸡蛋白溶液 |
1.在密闭容器中的一定量的混合气体发生反应:xA(g)+yB(g)?zC(g),平衡时,测得A的浓度为0.50mol•L-1,在温度不变时,把容器容积缩小到原来的0.5倍,使其重新达到平衡,测得A的浓度为0.90mol•L-1.下列有关判断正确的是( )
| A. | x+y<z | B. | 平衡逆向移动 | C. | A的转化率降低 | D. | C的体积分数升高 |
18.下列说法正确的是( )
| A. | 煤的干馏和石油的分馏均属化学变化 | |
| B. | 乙烯和苯都能使溴水褪色,褪色原理相同 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
5.化学与生活密切相关,下列说法不正确的是( )
| A. | 甘油可作护肤保湿剂 | |
| B. | 无水氯化钙可用作食品干燥剂 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
2.某中性有机物C10H20O2在稀硫酸作用下加热得到M和N两种物质,N经氧化最终可得到M,则该中性有机物可能有( )
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |