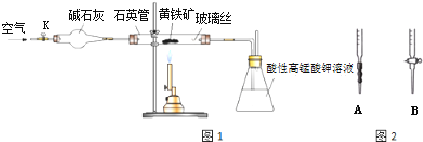
题目内容
3.下列各组物质在溶液中不发生化学反应而能共存的是( )| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
分析 A.四种物质在溶液中不反应,可以大量共存;
B.硫酸与氯化钡、氢氧化钠发生反应,硫酸钠与氯化钡反应;
C.硝酸银与氯化镁、盐酸均反应生成白色沉淀氯化银;
D.碳酸氢铵与氢氧化钠、盐酸反应,氢氧化钠与盐酸反应.
解答 解:A.Na2SO4、KNO3、Na2CO3、NH4Cl之间在溶液中不反应,可以大量共存,故A正确;
B.H2SO4与Na2SO4、NaOH均反应,BaCl2也和H2SO4反应,不能大量共存,故B错误;
C.AgNO3与MgCl2、HCl均反应生成白色沉淀氯化银,不能大量共存,故C错误;
D.NH4HCO3与NaOH、HCl均反应,NaOH和HCl也反应,不能大量共存,故D错误;
故选A.
点评 本题考查了离子反应及其应用,题目难度中等,明确离子反应发生条件为解答关键,试题侧重考查复分解反应的应用,有利于培养学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
14.下列实验操作能达到预期实验目的是( )
| 实验目的 | 实验操作 | |
| A | 鉴别Al3+和Fe3+ | 分别加入少量NaOH溶液 |
| B | 比较Fe和Cu的金属活动性 | 分别加入浓硝酸 |
| C | 证明品红溶液褪色的原因是通入了SO2 | 将褪色后的溶液再加热 |
| D | 分离乙酸乙酯和乙酸 | 加饱和NaOH溶液,蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
11.X、Y、Z、W和N均是由短周期元素组成的五种化合物.已知五种化合物水溶液的焰色反应均呈黄色,Y、Z和N均由三种元素组成.请根据题目要求回答下列问题.
(1)固体化合物X为浅黄色粉末,该化合物中含有的化学键有AC(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)写出X与二氧化碳反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
(3)下表为Y与Z实验的部分内容:
写出Y与稀硫酸反应的离子方程式S2O32-+2H+=S↓+SO2↑+H2O.
(4)写出含0.1mol Z的溶液与20mL 5mol•L-1的盐酸反应的离子反应式AlO2-+H2O+H+=Al(OH)3↓.实验③加热蒸发、灼烧得到的最终产物主要是Al2O3.
(5)化合物W和N可以相互转化:W$?_{CO_{2}+H_{2}O}^{△}$N.若有W和N•xH2O的混合物6.52g,加热到完全反应后,气体产物通过浓硫酸增重1.71g,剩余气体通过碱石灰增重1.10g,则混合物中W的质量为4.2g,N•xH2O的化学式为Na2CO3.7H2O.
(1)固体化合物X为浅黄色粉末,该化合物中含有的化学键有AC(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)写出X与二氧化碳反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
(3)下表为Y与Z实验的部分内容:
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
(4)写出含0.1mol Z的溶液与20mL 5mol•L-1的盐酸反应的离子反应式AlO2-+H2O+H+=Al(OH)3↓.实验③加热蒸发、灼烧得到的最终产物主要是Al2O3.
(5)化合物W和N可以相互转化:W$?_{CO_{2}+H_{2}O}^{△}$N.若有W和N•xH2O的混合物6.52g,加热到完全反应后,气体产物通过浓硫酸增重1.71g,剩余气体通过碱石灰增重1.10g,则混合物中W的质量为4.2g,N•xH2O的化学式为Na2CO3.7H2O.
18.以天然气替代石油生产液体燃料和基础化学品是当前化学研究和发展的重点.
(1)我国科学家包信和院士领衔的团队,创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产链烃X、芳烃Y和Z等重要化工原料,反应过程本身实现了CO2的零排放,碳原子利用效率达到100%.若X、Y、Z的相对分子质量分别为28、78、128,且X、Y的核磁共振氢谱只有一个峰,Z的核磁共振氢谱有二个峰.
①有关化学键键能数据如下:
写出甲烷一步生成X的热化学方程式2CH4(g)$\stackrel{催化剂}{→}$C2H4(g)+2H2(g)△H=+166.6kJ/mol,
硅化物晶格限域的单中心铁催化剂的作用是降低反应的活化能,加快反应的速率.
②甲烷生成芳烃Y的原子利用率为81.25%.
③Z的结构简式为(CH3)3CCH2C(CH3)3,其二氯取代物有6种.
(2)碳酸乙二醇酯在锂电池中有重要用途.已知:

①请以CO2、X、空气为原料,利用绿色化学原则制备碳酸乙二醇酯,写出有关反应的化学方程式 、
、 .
.
②生产1t碳酸乙二醇酯在理论上可以吸收0.5t CO2.
(1)我国科学家包信和院士领衔的团队,创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产链烃X、芳烃Y和Z等重要化工原料,反应过程本身实现了CO2的零排放,碳原子利用效率达到100%.若X、Y、Z的相对分子质量分别为28、78、128,且X、Y的核磁共振氢谱只有一个峰,Z的核磁共振氢谱有二个峰.
①有关化学键键能数据如下:
| 化学键 | H-H | C═C | C-C | C≡C | C-H |
| E/(kJ•mol-1) | 436.0 | 615 | 347.7 | 812 | 413.4 |
硅化物晶格限域的单中心铁催化剂的作用是降低反应的活化能,加快反应的速率.
②甲烷生成芳烃Y的原子利用率为81.25%.
③Z的结构简式为(CH3)3CCH2C(CH3)3,其二氯取代物有6种.
(2)碳酸乙二醇酯在锂电池中有重要用途.已知:

①请以CO2、X、空气为原料,利用绿色化学原则制备碳酸乙二醇酯,写出有关反应的化学方程式
 、
、 .
.②生产1t碳酸乙二醇酯在理论上可以吸收0.5t CO2.
15.-种免疫抑制剂麦考酚酸结构简式如图: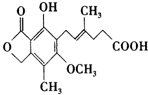 ,下列有关麦考酚酸说法不正确的是( )
,下列有关麦考酚酸说法不正确的是( )
 ,下列有关麦考酚酸说法不正确的是( )
,下列有关麦考酚酸说法不正确的是( )| A. | 分子式为C17H20O6 | |
| B. | 能与FeCl3溶液显色,与浓溴水反应,最多消耗量1 mol Br2 | |
| C. | 1mol麦考酚酸最多与3 mol NaOH反应 | |
| D. | 在一定条件下可发生加成,加聚,取代,消去四种反应 |
12.下列有机物互为同分异构体的是( )
| A. | 乙烷和乙烯 | B. | 正丁烷和异丁烷 | C. | 乙醇和乙酸 | D. | 葡萄糖和淀粉 |
1.准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol/LNaOH溶液滴定.下列说法正确的是( )
| A. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| B. | 滴定达到终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 | |
| D. | 随着NaOH溶液的滴入,锥形瓶中的pH由小变大 |