题目内容
13.黄铁矿是工业上制取硫酸的主要原料,其主要成分为FeS2,含少量杂质(杂质不含S元素,且高温下不反应).某化学兴趣小组用下列装置如图1测定黄铁矿中硫元素的质量分数.
称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次.已知:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4请回答下列问题:
(1)连接好装置,检查装置气密性的操作是向锥形瓶中加水浸没导气管末端,关闭K,微热石英管,观察到锥形瓶中有气泡冒出,冷却后导管内形成一端稳定的气柱
(2)通入空气的作用是提供反应所需O2,将生成的SO2全部赶入锥形瓶中.
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数偏低.(填“偏高”、“偏低”或“不变”)
(4)滴定时,应选择图2中的B(填字母序号)盛装标准H2C2O4溶液,根据由浅紫色突变为无色且半分钟内不再变色现象来判断滴定已经达到终点.
(5)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是48%.(保留到小数点后1位)
分析 (1)向锥形瓶中加水浸没导气管末端,关闭K,溶解微热石英管,根据锥形瓶中是否有气泡冒出,及冷却后导管内是否形成一端稳定的气柱判断该装置的稳定性;
(2)空气中含有氧气,空气还能够将生成的二氧化硫驱赶到锥形瓶中;
(3)若鼓入的空气速率过快,导致二氧化硫没有完全被酸性高锰酸钾溶液吸收;
(4)A为碱式滴定管,B为酸式滴定管,草酸为酸性溶液,应该使用酸式滴定管;滴定结束前溶液为紫红色,滴定结束后变为无色,据此判断滴定终点;
(5)根据反应5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O及草酸的量计算出25mL溶液中剩余的高锰酸钾的物质的量,再计算出100ml溶液中剩余的高锰酸钾的物质的量,从而得出二氧化硫消耗的高锰酸钾的物质的量,再根据反应2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4计算出二氧化硫的物质的量,根据S原子守恒计算出样品中S的质量及质量分数.
解答 解:(1)连接好装置,检查装置气密性的方法为:向锥形瓶中加水浸没导气管末端,关闭K,微热石英管,观察到锥形瓶中有气泡冒出,冷却后导管内形成一端稳定的气柱,
故答案为:向锥形瓶中加水浸没导气管末端,关闭K,微热石英管,观察到锥形瓶中有气泡冒出,冷却后导管内形成一端稳定的气柱;
(2)煅烧黄铁矿时需要氧气,则通入空气的目的是提供反应需要的氧气,另外通入空气后还可以将生成的二氧化硫完全赶入锥形瓶中,从而减小实验误差,
故答案为:提供反应所需O2,将生成的SO2全部赶入锥形瓶中;
(3)若实验过程中鼓入空气的速率过快,会导致部分二氧化硫没有被酸性高锰酸钾溶液吸收,则测得的硫元素的质量分数会偏低,
故答案为:偏低;
(4)草酸显示酸性,需要选用酸式滴定管盛放,即应该选用B盛放草酸溶液;滴定结束时溶液由浅紫色变为无色,则滴定终点的现象为:由浅紫色突变为无色且半分钟内不再变色,
故答案为:B;由浅紫色突变为无色且半分钟内不再变色;
(5)0.23mol/L标准H2C2O4溶液21.73mL中含有草酸的物质的量为:0.23mol/L×0.02173L=0.0050mol,根据反应5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O可知,0.0050mol草酸完全反应消耗高锰酸根离子的物质的量为:0.0050mol×$\frac{2}{5}$=0.002mol,
原100mL滴定后的高锰酸钾溶液中含有高锰酸钾的物质的量为:0.002mol×$\frac{100ml}{25ml}$=0.008mol,
100mL 0.2mol/L酸性KMnO4溶液中含有高锰酸钾的物质的量为:0.2mol/L×0.1L=0.02mol,则二氧化硫消耗的高锰酸钾的物质的量为:0.02mol-0.008mol=0.012mol,根据反应2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4可知,二氧化硫的物质的量为:0.012mol×$\frac{5}{2}$=0.03mol,原样品中含有S的质量为:32g/mol×0.03mol=0.96g,含有硫元素的质量分数为:$\frac{0.96g}{2g}$×100%=48%,
故答案为:48%.
点评 本题考查物质组成及含量的测定方法,题目难度较大,明确测定原理为解答关键,注意掌握化学实验基本操作方法,明确中和滴定原理及操作方法,试题侧重考查学生灵活应用基础知识的能力.

| A | B | |||
| C | D | E |
| A. | 简单离子的半径:D>E>C>B | |
| B. | 氧化物对应的水化物的酸性:E-定强于D | |
| C. | B、D分别与氢元素形成的化合物的沸点:D>B | |
| D. | A的最高价氧化物的水化物能与A的氢化物反应生成离子化合物 |
 汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
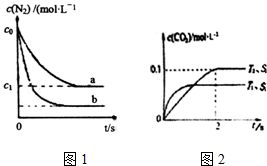
汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.(1)汽车内燃机工作时发生反应N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T0℃时将等物质的量的N2(g)和O2(g)充入恒容密闭容器中发生反应,图1曲线a表示该反应在T0℃下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是ad.
a.温度T0℃下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$
b.温度T0℃下,随着反应的进行,混合气体的密度减小
c.曲线b对应的条件改变可能是充入了NO气体
d.若曲b对应的条件改变是温度,可判断△H>0
(2)汽车安装尾气催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H.某科研小组为了探究催化剂的效果,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/(×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
②在该温度下,反应的平衡常数K=5000.
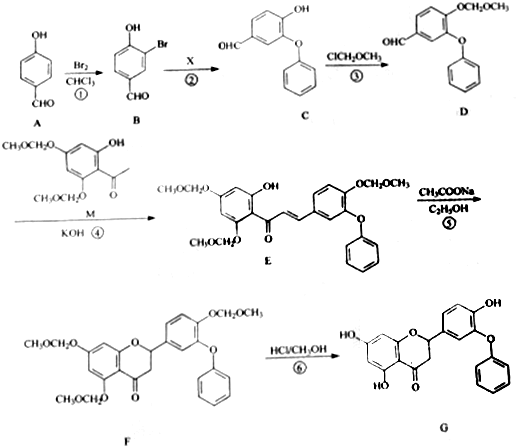
③在使用等质量催化剂时,增大固体催化剂的表面积可提高化学反应速率.下图表示在其他条件不变时,CO2的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.由此可知该反应的△H<0(填“>”“<”),原因是温度T1到达平衡的时间短,反应速率快,故温度T2<T1,温度越高,平衡时CO2的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0.
若催化剂的表面积S1>S2,在图2中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
④假设在密闭容器中发生上述反应,达到平衡时能提高NO转化率的措施是降低反应体系的温度或缩小容器的体积.
(3)用NH3还原NOx生成N2和H2O也可以减少污染.现有NO、NO2的混合气3L,可用同温同压下3.5L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为1:3.
| A. | 过氧化钠的电子式: | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 乙烯的结构简式为CH2CH2 | D. | 硫原子的结构示意图: |
| A. | 不可能生成90g 乙酸乙酯 | B. | 生成的乙酸乙酯中含有18O | ||
| C. | 可能生成61.6g 乙酸乙酯 | D. | 生成的水分子中一定含有18O |
| A. | CH2=CHCl | B. |  | C. |  | D. |  |
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
 .
.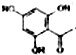 制得,写出同时满足下列条件的
制得,写出同时满足下列条件的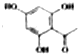 的一种同分异构体的结构简式
的一种同分异构体的结构简式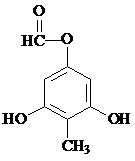 或
或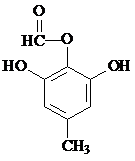 .
. 为原料,合成
为原料,合成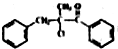 ,写出合成流程图
,写出合成流程图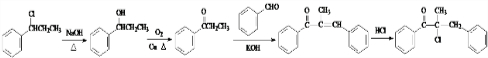 (无机试剂作用).合成流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
(无机试剂作用).合成流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH. .
.