题目内容
12.下列有机物互为同分异构体的是( )| A. | 乙烷和乙烯 | B. | 正丁烷和异丁烷 | C. | 乙醇和乙酸 | D. | 葡萄糖和淀粉 |
分析 根据分子式相同,结构不同的化合物互为同分异构体,据此结合选项判断.
解答 解:A.乙烷和乙烯的分子式不同,不是同分异构体,故A错误;
B.正丁烷和异丁烷分子式相同,结构不同,是同分异构体,故B正确;
C.乙醇和乙酸的分子式不同,不是同分异构体,故C错误;
D.葡萄糖和淀粉的分子式不同,不是同分异构体,故D错误.
故选B.
点评 本题考查有机物的名称与结构、同分异构体等,难度不大,根据名称书写结构是解题关键.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
3.下列各组物质在溶液中不发生化学反应而能共存的是( )
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
7.可以用来鉴别甲烷和乙烯的试剂是( )
| A. | 水 | B. | 溴水 | C. | 紫色石蕊溶液 | D. | 四氯化碳 |
17.对下列物质用途的描述不符合事实的是( )
| A. | 硅酸钠可用作木材防火涂料 | B. | Fe2O3可用作外墙涂料 | ||
| C. | 过氧化钠可用作潜艇供氧剂 | D. | 铝制容器可以贮运稀硝酸 |
1.一种气态烷烃与一种气态炔烃等体积混合,测得混合气体在标准状况下的密度为1.25g/L,则构成这种混合气体的烷烃和炔烃可能是( )
| A. | 甲烷,丙炔 | B. | 甲烷,丁炔 | C. | 乙烷,乙炔 | D. | 乙烷,丙炔 |
 .
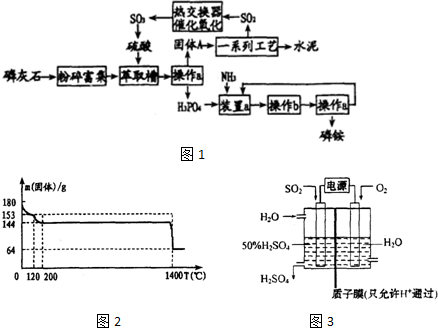
.
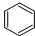 c.
c.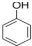
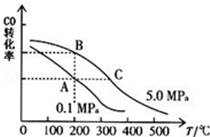 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题