题目内容
 某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响.部分实验用表如下:
某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响.部分实验用表如下:| 实验 编号 | 温度/K | 盐酸浓度 /mol?L-1 | 醋酸浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | 0.20 | |||
| ⑤ | 0.20 |
(2)上表实验①中,镁条消失的时间为20s.实验过程中,镁条剩余质量与时间关系如图:
Ⅰ假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是
Ⅱ若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解).
考点:探究影响化学反应速率的因素
专题:实验设计题
分析:(1)实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,则④⑤只有反应温度不相同,浓度必须相同;
(2)Ⅰ.能够计算出消耗氯化氢的物质的量,但不知道盐酸体积,无法计算消耗的盐酸的浓度,无法根据反应速率v=
计算;
Ⅱ.根据浓度、温度对反应速率的影响,判断反应时间,然后画出镁条质量与时间关系曲线.
(2)Ⅰ.能够计算出消耗氯化氢的物质的量,但不知道盐酸体积,无法计算消耗的盐酸的浓度,无法根据反应速率v=
| △c |
| △t |
Ⅱ.根据浓度、温度对反应速率的影响,判断反应时间,然后画出镁条质量与时间关系曲线.
解答:
解:(1)根据实验目的“实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响”,则实验④和⑤的温度不相同即可,两个实验的浓度必须相等,则实验⑤和实验④的浓度相同,
故答案为:④298或308;⑤308或298,0.20,0.20;
(2)Ⅰ.能够计算出消耗的HCl的物质的量,但缺少盐酸的体积,无法计算出氯化氢的浓度变化,则无法求算出盐酸的反应速率,
故答案为:盐酸的体积;
Ⅱ.该反应温度每升高10℃,反应速率是原来的2倍,温度相同、浓度相同时,醋酸的平均反应速度是盐酸的
,与①比较,②温度升高10℃,反应速率是原来的2倍,所以②反应时间缩短到10min,④的反应速率是①的
,则反应时间是①的2倍,即40min,所以其图象为 ,
,
故答案为: .
.
故答案为:④298或308;⑤308或298,0.20,0.20;
(2)Ⅰ.能够计算出消耗的HCl的物质的量,但缺少盐酸的体积,无法计算出氯化氢的浓度变化,则无法求算出盐酸的反应速率,
故答案为:盐酸的体积;
Ⅱ.该反应温度每升高10℃,反应速率是原来的2倍,温度相同、浓度相同时,醋酸的平均反应速度是盐酸的
| 1 |
| 2 |
| 1 |
| 2 |
 ,
,故答案为:
 .
.
点评:本题考查温度、浓度对反应速率的影响,题目难度中等,注意明确探究外界条件对反应速率的影响时,必须是只有一个条件不同,其它条件相同时,才能比较得出结论.

练习册系列答案
相关题目
在一定条件下,在容积为2L的密闭容器中,将2mol 气体M和3mol N气体混合,发生如下反应:2M(g)+3N(g)?x Q(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4mol/L,下列有关叙述正确的是( )
| A、x值为2 |
| B、混合气体的密度增大 |
| C、平衡时N的浓度为0.6 mol/L |
| D、N的转化率为80% |
除去混在Na2CO3粉末中的少量NaHCO3最合理的方法是( )
| A、加热 |
| B、加NaOH溶液 |
| C、加盐酸 |
| D、加CaCl2溶液 |
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应极小,因而被广泛适用于敏感细菌所致的尿路感染、皮肤软组织感染以及急性扁桃体炎、急性咽炎、中耳炎和肺部感染等的治疗.已知肽键可以在碱性条件下水解,下列对头孢羟氨苄的说法中正确的是( )
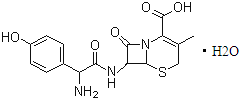

| A、头孢羟氨苄的化学式为C16H16N3O5S?H2O |
| B、1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br2 3mol |
| C、在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2 |
| D、头孢羟氨苄在空气中能稳定存在 |
下列说法正确的是( )
| A、化合反应一定是放热反应 |
| B、乙二醇和丙三醇都易溶于水和乙醇 |
| C、牺牲阳极的阴极保护法是利用了电解原理 |
| D、相同条件下,CuSO4溶液比FeCl3溶液使H2O2分解速率更快 |
下列各组物质不用任何外加试剂,只用胶头滴管和试管就能鉴别的是( )
| A、AgNO3溶液和NaCl溶液 |
| B、BaCl2溶液和KHSO4溶液 |
| C、NaHCO3溶液和盐酸 |
| D、Na2CO3溶液和盐酸 |

 用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.
用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.