题目内容
19.一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气,其电极反应为:X极:CH4+10OH--8e-═CO32-+7H2O,Y极:4H2O+2O2+8e-═8OH-,关于此燃料电池的有关说法错误的是( )| A. | X为负极、Y为正极 | |
| B. | 工作一段时间后,KOH的物质的量不变 | |
| C. | 在标况下通过5.6 L O2完全反应则有l.0 mol 电子发生转移 | |
| D. | 该电池工作时甲烷一极附近溶液 pH降低 |
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,根据电极反应确定液的pH变化情况以及电子转移和物质量之间的关系.
解答 解:AA.碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,所以X极是负极,通入氧气的一极为原电池的正极,发生还原反应,Y极为正极,故A正确;
B.根据总反应:CH4+2O2+2OH-=CO32-+3H2O,则氢氧化钾被消耗,物质的量减小,故B错误;
C.在标准状况下通入5.6L即0.25molO2完全反应,根据电极反应式:O2+2H2O+4e-=4OH-,转移电子是1.0mol,故C正确;
D.该电池工作时甲烷电极发生的电极反应为:CH4+10OH--8e-=CO32-+7H2O,该极氢氧根被消耗,所以该极附近溶液的pH降低,故D正确;
故选B.
点评 本题考查了原电池工作原理,题目难度中等,本题中注意明确电极反应式的书写,正确判断两极的化学反应为解答关键,注意掌握原电池工作原理及应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
8.铬及其化合物在工业上有许多用途,但化工废料铬渣对人体健康有很大危害,以制革工也产生的含铬污泥为原料,回收污泥中三价铬的工艺流程图如图所示(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+)
:

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用时2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Al3+、Ca2+、Mg2+(填离子符号).
(5)每生成1molCr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
:

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用时2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Al3+、Ca2+、Mg2+(填离子符号).
(5)每生成1molCr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
7.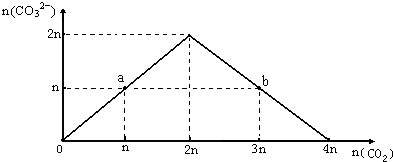 向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )
向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )
 向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )
向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )| A. | a、b溶液与同浓度盐酸完全反应时,消耗盐酸的体积相同 | |
| B. | a溶液中水的电离程度与b溶液中水的电离程度相同 | |
| C. | a、b两溶液都满足:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| D. | 将a、b两点混合后溶液满足:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
14.用石墨作电极电解4mol•L-1的 CuSO4溶液,当c(Cu2+)为0.1mol•L-1时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状态( )
| A. | Cu(OH)2 | B. | CuSO4•5H2O | C. | CuSO4 | D. | CuO |
11.甲、乙两个电解池均以Pt为电极,且互相串联.甲池盛有CuSO4溶液,乙池中盛有一定量的某盐溶液.通电一段时间后,测得甲池电极质量增加0.64g,乙池电极上析出0.24g金属,则乙池中的溶质可能是( )
| A. | MgSO4 | B. | Al(NO3)3 | C. | CuSO4 | D. | Na2SO4 |
8.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数只和为15;X和Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下密度为0.76g•L-1,W在短周期主族元素中原子半径最大.下列说法正确的是( )
| A. | 原子半径大小关系为Z>Y>X | |
| B. | 由X、Z、M、W四种元素形成的化合物都不能用于焙制糕点的食品工业 | |
| C. | 由X、Y、Z、M四种元素形成的所有化合物既能和强酸反应又能和强碱反应 | |
| D. | 由X与M形成的不同分子的空间构型可能是正四面体型、直线型或平面型等 |
9.下列溶液中,Na+浓度最大的是( )
| A. | 0.5mol/LNaCl溶液 | B. | 1L3mol/LNa2SO4溶液 | ||
| C. | 0.4mol/LNaOH溶液 | D. | 2L0.15mol/LNa3PO4溶液 |
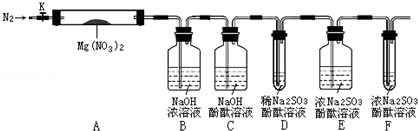
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.