题目内容
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A、该反应的化学方程式为3X+Y═2Z |
| B、2 min时,反应达最大限度,但化学反应仍在进行 |
| C、反应开始至2 min,Z的反应速率为0.10 mol?L-1?min-1 |
| D、反应达到平衡时,压强是开始时的0.9倍 |
考点:化学平衡的计算
专题:
分析:A、随反应进行反应物的物质的量减小,生成物的物质的量增大.反应结束反应物的物质的量为定值,反应为可逆反应,据此判断;
B、根据图可知该反应为可逆反应,所以达到反应限度时,正逆反应还在进行,不过此时正逆反应速率相等,组成不变,据此判断;
C、根据v=
计算以Z表示的平均反应速率;
D、利用压强之比等于物质的量之比计算判断.
B、根据图可知该反应为可逆反应,所以达到反应限度时,正逆反应还在进行,不过此时正逆反应速率相等,组成不变,据此判断;
C、根据v=
| △c |
| △t |
D、利用压强之比等于物质的量之比计算判断.
解答:
解:A、由图可知随反应进行X、Y的物质的量变小,Z的物质的量变大,所以X、Y为反应物,z为生成物,反应结束各物质的物质的量不变,所以反应为可逆反应,故A错误;
B、根据图可知该反应为可逆反应,所以达到反应限度时,正逆反应还在进行,不过此时正逆反应速率相等,组成不变,故B正确;
C、由图可知2min内Z的物质的量变化量为0.2mol,所以2min内以Z表示的平均反应速率v(Z)=
=0.05mol/(L?min),故C错误;
D、由图可知开始混合气体的总的物质的量为2mol,平衡时混合气体的物质的量为(0.9+0.7+0.2)mol=1.8mol,压强之比等于物质的量之比,所以反应达平衡此时体系的压强是开始时
=0.9倍,故D正确;
故选:AC.
B、根据图可知该反应为可逆反应,所以达到反应限度时,正逆反应还在进行,不过此时正逆反应速率相等,组成不变,故B正确;
C、由图可知2min内Z的物质的量变化量为0.2mol,所以2min内以Z表示的平均反应速率v(Z)=
| ||
| 2min |
D、由图可知开始混合气体的总的物质的量为2mol,平衡时混合气体的物质的量为(0.9+0.7+0.2)mol=1.8mol,压强之比等于物质的量之比,所以反应达平衡此时体系的压强是开始时
| 1.8mol |
| 2mol |
故选:AC.
点评:本题考查反应速率、方程式书写、化学平衡计算等,难度不大,关键是读懂图象运用所学知识解决问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
国际巴黎车展示上,世界各大汽车商纷纷推出环保动力小汽车,使用的新型环保电池为( )
| A、氢氧燃料电池 | B、锌锰电池 |
| C、镍镉电池 | D、铅蓄电池 |
下列分子式只能表示一种物质的是( )
| A、C3H6Cl2 |
| B、C3H8 |
| C、C2H6O |
| D、C8H10 |
把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和).向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余.此时,溶液中的Fe2+物质的量浓度为( )
| A、0.5 mol/L |
| B、1.5 mol/L |
| C、1.0 mol/L |
| D、2mol/L |
下列物质在水溶液中的电离方程式正确的是( )
| A、Na2CO3=Na22++CO32- |
| B、NaHSO4=Na++H++SO42- |
| C、CH3COOH=H++CH3COO- |
| D、H2CO3=2H++CO32- |
下列图标是国家节水标志的是( )
A、 |
B、 |
C、 |
D、 |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量).下列判断正确的是( )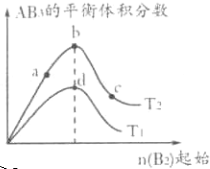

| A、若T2>T1,达到平衡时b、d点的反应速率为vd>vb |
| B、若T2>T1,则正反应一定是放热反应 |
| C、达到平衡时A2的转化率大小为b>a>c |
| D、在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a |
