题目内容
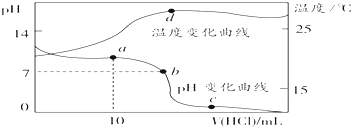 室温下,将1.00mol?L-1盐酸滴入20.00mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.00mol?L-1盐酸滴入20.00mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )| A、a点溶液中离子浓度大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、b点溶液中离子浓度大小关系:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| C、c点溶液中离子浓度大小关系:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| D、d点时溶液温度达到最高,之后温度略有下降,原因是NH3?H2O电离 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:A.a点加入了10mL盐酸,根据反应后的溶液的组成分析各离子浓度大小;
B.b点pH=7,则c(H+)=c(OH-),溶液中电荷守恒为c(NH4+)+c(H+)=c(Cl-)+c(OH-);
C.c点盐酸过量,溶液中电荷守恒为c(NH4+)+c(H+)=c(Cl-)+c(OH-);
D.根据d点盐酸和氨水恰好完全反应,放热最多分析.
B.b点pH=7,则c(H+)=c(OH-),溶液中电荷守恒为c(NH4+)+c(H+)=c(Cl-)+c(OH-);
C.c点盐酸过量,溶液中电荷守恒为c(NH4+)+c(H+)=c(Cl-)+c(OH-);
D.根据d点盐酸和氨水恰好完全反应,放热最多分析.
解答:
解:A.a点加入了10mL氨水,反应后溶质为氯化铵和氨水,其中氯化铵0.01mol,一水合氨物质的量为0.01mol,反应后溶液酸性碱性,c(OH-)>c(H+),c(NH4+)>c(Cl-),即c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A正确;
B.b点pH=7,则c(H+)=c(OH-),溶液中电荷守恒为c(NH4+)+c(H+)=c(Cl-)+c(OH-),则c(Cl-)=c(NH4+),即c(NH4+)=c(Cl-)>c(H-)=c(OH-),故B正确;
C.c点盐酸已经过量,溶液显示酸性,但是溶液中一定满足电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),故C正确;
D.d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选:D.
B.b点pH=7,则c(H+)=c(OH-),溶液中电荷守恒为c(NH4+)+c(H+)=c(Cl-)+c(OH-),则c(Cl-)=c(NH4+),即c(NH4+)=c(Cl-)>c(H-)=c(OH-),故B正确;
C.c点盐酸已经过量,溶液显示酸性,但是溶液中一定满足电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),故C正确;
D.d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选:D.
点评:本题考查水溶液中的电离平衡以及酸碱中和滴定,明确滴定曲线中各点的pH是解答的关键,并学会利用物料守恒、电荷守恒来解答此类习题,题目难度中等.

练习册系列答案
相关题目
实验中需1mol/L的NaOH溶液950mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是( )
| A、1000mL,38.0g |
| B、1000mL,40.0g |
| C、任意规格,38.0g |
| D、500mL,20.0g |
把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和).向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余.此时,溶液中的Fe2+物质的量浓度为( )
| A、0.5 mol/L |
| B、1.5 mol/L |
| C、1.0 mol/L |
| D、2mol/L |
下列图标是国家节水标志的是( )
A、 |
B、 |
C、 |
D、 |
将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
| A、只有AgBr沉淀生成 |
| B、AgCl和AgBr沉淀都有,但以AgCl沉淀为主 |
| C、AgCl和AgBr沉淀等量生成 |
| D、AgCl和AgBr沉淀都有,但以AgBr沉淀为主 |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量).下列判断正确的是( )

| A、若T2>T1,达到平衡时b、d点的反应速率为vd>vb |
| B、若T2>T1,则正反应一定是放热反应 |
| C、达到平衡时A2的转化率大小为b>a>c |
| D、在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a |
人体最主要的供能物质是( )
| A、糖类 | B、脂肪 |
| C、蛋白质 | D、无机盐 |
水热法制备直径为1~100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中不正确的是( )
| A、a=4 |
| B、O2是氧化剂 |
| C、将Y均匀分散到水中形成的体系具有丁达尔效应 |
| D、每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol |