题目内容
已知A、B、C、D、E、F、G都是中学化学常见的物质,如图中A为淡黄色固体,B、C为溶液,D、G为无色气体,E、F为白色沉淀.

①写出B→C的离子方程式
②写出D和G反应的化学方程式
③写出过量的D通入Ba(OH)2溶液中的离子方程式
④从上图出现的物质中选出反应物,写出一个置换反应,以验证氯元素原子的氧化性比硫元素原子的氧化性强 .

①写出B→C的离子方程式
②写出D和G反应的化学方程式
③写出过量的D通入Ba(OH)2溶液中的离子方程式
④从上图出现的物质中选出反应物,写出一个置换反应,以验证氯元素原子的氧化性比硫元素原子的氧化性强
考点:无机物的推断
专题:推断题
分析:B与硫化氢反应得到淡黄色固体A,考虑A为硫,B与氯气反应得到C,C与硝酸钡反应得到白色沉淀F,且A与无色气体反应得到D,D与水反应得到B,可推知B为H2SO3,A为S,G为O2,D为SO2,C为H2SO4,E为BaSO3,F为BaSO4,据此解答.
解答:
解:B与硫化氢反应得到淡黄色固体A,考虑A为硫,B与氯气反应得到C,C与硝酸钡反应得到白色沉淀F,且A与无色气体反应得到D,D与水反应得到B,可推知B为H2SO3,A为S,G为O2,D为SO2,C为H2SO4,E为BaSO3,F为BaSO4,
①B→C的离子方程式为:H2SO3+Cl2=4H++SO42-+2Cl-,故答案为:H2SO3+Cl2=4H++SO42-+2Cl-;
②D和G反应的化学方程式为:2SO2+O2
2 SO3,故答案为:2SO2+O2
2 SO3;
③过量的D通入Ba(OH)2溶液中的离子方程式为:OH-+SO2=HSO3-,故答案为:OH-+SO2=HSO3-;
④从上图出现的物质中选出反应物,用一个置换反应,以验证氯元素原子的氧化性比硫元素原子的氧化性强,该反应为:H2S+Cl2
S↓+2HCl,故答案为:H2S+Cl2
S↓+2HCl.
①B→C的离子方程式为:H2SO3+Cl2=4H++SO42-+2Cl-,故答案为:H2SO3+Cl2=4H++SO42-+2Cl-;
②D和G反应的化学方程式为:2SO2+O2
| ||
| △ |
| ||
| △ |
③过量的D通入Ba(OH)2溶液中的离子方程式为:OH-+SO2=HSO3-,故答案为:OH-+SO2=HSO3-;
④从上图出现的物质中选出反应物,用一个置换反应,以验证氯元素原子的氧化性比硫元素原子的氧化性强,该反应为:H2S+Cl2
| ||
| ||
点评:本题考查无机物推断,涉及硫元素单质化合物的性质与转化,物质的颜色是推断突破口,难度中等.

练习册系列答案
相关题目
茶叶中铁元素的检验可经过以下四个步骤完成:将茶叶灼烧灰化→用浓硝酸溶解茶叶灰→过滤得到的滤液→检验滤液中的Fe3+.如图是可能用到的实验用品.
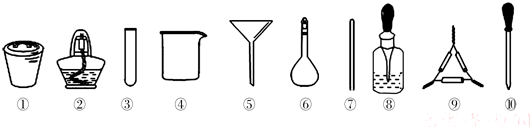
有关该实验的说法中正确的是( )

有关该实验的说法中正确的是( )
| A、第一步需选用仪器①、②和⑨,①的名称叫钳埚 |
| B、第二步用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦ |
| C、要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 |
| D、第四步,若滤液中含有Fe3+,加入⑧中的溶液后滤液会显红色 |
如图1可实现由亚硫酸钠和硫粉反应制硫代硫酸钠(Na2S2O3).已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2.下列说法错误的是( )

| A、盛装浓硫酸的仪器的名称为分液漏斗 |
| B、B、D中都可以盛放氢氧化钠溶液,防止污染 |
| C、该装置设计不够严密,可能会出现倒吸 |
| D、析出硫代硫酸钠晶体的方法是蒸发结晶 |
 在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0.CH3OH的浓度随时间变化如图,下列说法不正确的是( )
在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0.CH3OH的浓度随时间变化如图,下列说法不正确的是( )| A、从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L?min) |
| B、从20分钟到25分钟达到新的平衡,可能是增大压强 |
| C、其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小 |
| D、从开始到25分钟,CO2的转化率是70% |
下列关于物质用途的说法正确的是( )
①晶体硅是良好的半导体材料,可以制成光电池;
②2CO(g)=2C(s)+O2(g)△H>0该反应可在高温下自发进行;
③氢氟酸可以用来刻蚀玻璃;
④纯净的二氧化硅是制备光导纤维的原料;
⑤利用氯气的毒性可以消灭田鼠;
⑥将Fe(OH)3胶体和泥水分别进行过滤,发现均不能通过滤纸孔隙.
①晶体硅是良好的半导体材料,可以制成光电池;
②2CO(g)=2C(s)+O2(g)△H>0该反应可在高温下自发进行;
③氢氟酸可以用来刻蚀玻璃;
④纯净的二氧化硅是制备光导纤维的原料;
⑤利用氯气的毒性可以消灭田鼠;
⑥将Fe(OH)3胶体和泥水分别进行过滤,发现均不能通过滤纸孔隙.
| A、②④⑤⑥ | B、①③④⑤ |
| C、①②④⑥ | D、③④⑤⑥ |
短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A、X的最高价氧化物对应水化物的酸性比W的弱 |
| B、Y分别与Z、W形成的化合物中化学键类型相同 |
| C、原子半径大小顺序:r(Z)>r(W)>r(X)>r(Y) |
| D、Y的气态简单氢化物的热稳定性比W的弱 |
 由短周期元素组成的甲、乙和丙均为中学常见物质,一定条件下,它们存在如下转化关系:
由短周期元素组成的甲、乙和丙均为中学常见物质,一定条件下,它们存在如下转化关系: