题目内容
9.下列离子中,电子数大于质子数,且质子数大于中子数的是( )| A. | OH- | B. | Mg2+ | C. | OD- | D. | D3O+ |
分析 电子数大于质子数,则微粒带负电,质子数大于中子数,只能是计算微粒的原子中质子数与中子数的多少,其中明确氢元素的不同原子中中子个数的情况是解决此题的必要条件.
解答 解:A、OH-微粒带负电,电子数大于质子数,质子数为8+1=9,中子数为8+0=8,故A正确;
B、Mg2+微粒带正电,电子数小于质子数,质子数为12,中子数为12,故B错误;
C、OD-微粒带负电,电子数大于质子数,质子数为8+1=9,中子数为8+1=9,故C错误;
D、D3O+微粒带正电,电子数小于质子数,质子数为8+1×3=11,中子数为8+1×3=11,故D错误;
故选A.
点评 本题考查微粒结构,难度不大,解题的关键是对相关原子的结构的把握,属基础性知识考查题.

练习册系列答案
相关题目
20.下列说法正确的是(NA 表示阿伏加德罗常数的值)( )
| A. | 16.9 克过氧化钡(BaO2)固体中阴阳离子总数为0.3NA | |
| B. | 标准状况下,11.2L CHCl3中所含有的原子总数为2.5NA | |
| C. | 一定条件下,2.6 g 乙炔、苯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1 mol 甲基与1mol 羟基所含电子数均为10 NA 个 |
17.下列图示与对应的叙述相符的是( )

| A. | 图1表示0.1000mol•L-1NaOH溶液滴定20.00ml 0.1000 mol•L-1醋酸溶液得到滴定曲线 | |
| B. | 图2所示在H2S溶液导电性实验中,曲线可确定通入的气体X为Cl2 | |
| C. | 图3在其它条件不变时,2SO2(g)+O2(g)?2SO3(g)转化关系中,纵坐标表示O2的转化率 | |
| D. | 由图4所示曲线可知,酶催化比化学催化的效果好 |
4.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图1所示:

(1)从反应开始到10s,用Z表示的反应速率为0.079mol/(L•s).
(2)该反应的化学方程式为X+Y?2Z.
(3)10s后的某一时刻(t1)改变了外界条件,其反应速率随时间的变化图象如图2所示:则下列说法符合该图象的是CD
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
(4)其化学平衡常数K和温度t的关系如表:
由此判断该反应为放热反应(填“吸热”或“放热”).
(5)根据以上反应特点,为使反应的反应速率增大,且平衡向正反应方向移动,可采取的措施是ce.
a.及时分离出Z气体 b.适当提高温度 c.增大Y的浓度
d.选择高效的催化剂 e.使容器体积收缩,增大压强 f.适当降低温度.

(1)从反应开始到10s,用Z表示的反应速率为0.079mol/(L•s).
(2)该反应的化学方程式为X+Y?2Z.
(3)10s后的某一时刻(t1)改变了外界条件,其反应速率随时间的变化图象如图2所示:则下列说法符合该图象的是CD
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
(4)其化学平衡常数K和温度t的关系如表:
| t/℃ | 700 | 800 | 830 | 1000 |
| K | 20 | 10 | 1.0 | 0.5 |
(5)根据以上反应特点,为使反应的反应速率增大,且平衡向正反应方向移动,可采取的措施是ce.
a.及时分离出Z气体 b.适当提高温度 c.增大Y的浓度
d.选择高效的催化剂 e.使容器体积收缩,增大压强 f.适当降低温度.
14.下列变化全部属于化学变化的是( )
| A. | 煤的干馏,石油分馏 | B. | 石油裂解,煤的气化 | ||
| C. | 金属导电,熔融氯化钠导电 | D. | 金属的焰色反应,浓硫酸吸水 |
1.已知五种短周期元素的原子半径及主要化合价如表,下列叙述正确的是( )
| L | M | Q | R | T | |
| 原子半径 | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 王要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L 和 Q 形成的化合物含极性共价键 | |
| B. | L、R 的单质与盐酸反应速率:R>L | |
| C. | T、Q 的氢化物常温常压下均为无色气体 | |
| D. | M 极易与 T 反应 |
18.有关营养物质的说法正确的是( )
| A. | 在淀粉与稀硫酸共热后的溶液中,滴加银氨溶液,检验水解产物中的葡萄糖 | |
| B. | 纤维素在人体内可水解生成葡萄糖,进而被氧化为二氧化碳和水,释放能量 | |
| C. | 油脂的水解在碱性条件下可生产肥皂,在酸性条件下生成甘油和高级脂肪酸 | |
| D. | 蛋白质水解的最终产物是氨基酸;遇重金属盐则发生盐析,稀释后仍能溶解 |
13.下列有关物质的性质叙述不正确的是( )
| A. | 蛋白质水解的最终产物都是α-氨基酸 | |
| B. | 臭氧可用于自来水的消毒,是由于臭氧具有强的氧化性 | |
| C. | 工业上生产氨气时可以用分离出氨气的方法提高转化率,是利用氨易液化的性质 | |
| D. | 氧化铝能与氢氧化钠溶液反应,又能与盐酸反应,是因为氧化铝是两性氧化物 |
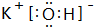 ②HClO的结构式H-O-Cl
②HClO的结构式H-O-Cl
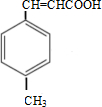 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$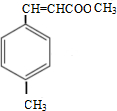 +H2O
+H2O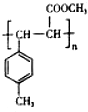 .
.