题目内容
14.下列变化全部属于化学变化的是( )| A. | 煤的干馏,石油分馏 | B. | 石油裂解,煤的气化 | ||
| C. | 金属导电,熔融氯化钠导电 | D. | 金属的焰色反应,浓硫酸吸水 |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化与物理变化的本质区别是有无新物质生成,据此抓住化学变化和物理变化的区别结合事实进行分析判断即可.
解答 解:A.煤在高温条件下,经过干馏生成粗氨水、煤焦油、焦炉气以及焦炭等物质,发生化学变化,石油分馏得到汽油、柴油等是利用了物质的沸点不同而分离的方法,属于物理变化,故A错误;
B.煤的气化是碳和水反应生成氢气和CO的过程,为化学变化,石油裂解是深度裂化以获得短链不饱和烃为主要成分的石油加工过程.(主要为乙烯,丙烯,丁二烯等不饱和烃),为化学变化,故B正确;
C.金属单质含有自由电子能导电,没有新物质生成,属于物理变化,熔融氯化钠导电,是氯化钠自身完全电离出自由移动的氯离子和钠离子导电,但无新物质生成,属于物理变化,故C错误;
D.焰色反应是金属元素的一种性质,是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,不同的金属元素呈现出不同的焰色反应,没有新物质生成,属于物理变化,浓硫酸吸水,是硫酸浓度变稀,溶剂量在增加,没有新物质生成,属于物理变化,故D错误;
故选B.
点评 本题考查物理变化与化学变化的区别与联系,难度不大,解答时要分析变化过程中是否有新物质生成,这里的新物质是指和变化前的物质是不同种的物质,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.

练习册系列答案
相关题目
4.甲、乙两种物质的溶解度曲线如图所示.下列叙述正确的是( )


| A. | 将甲的溶液从t2℃降到t1℃,其溶质的质量分数一定减小 | |
| B. | t2℃时,甲、乙的饱和溶液各100g,其溶质的质量一定相等 | |
| C. | 当温度高于0℃而低于t1℃时,乙的溶解度比甲的溶解度大 | |
| D. | t2℃时,蒸发溶剂可使乙的饱和溶液析出晶体后变为不饱和溶液 |
5.下列有关基本营养物质的说法中,错误的是( )
| A. | 淀粉遇碘化钾溶液变蓝 | |
| B. | 葡萄糖和果糖互为同分异构体 | |
| C. | 利用油脂在碱性条件下水解可制取肥皂 | |
| D. | 用灼烧并闻气味的方法鉴别羊毛织物和棉织物 |
9.下列离子中,电子数大于质子数,且质子数大于中子数的是( )
| A. | OH- | B. | Mg2+ | C. | OD- | D. | D3O+ |
19.X、Y、W、Q 四种元素在元素周期表中的位置如图,下列叙述错误的是( )
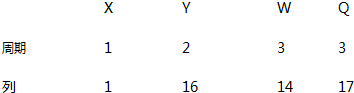
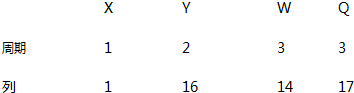
| A. | Y 的氢化物沸点高于 Q 的氢化物沸点 | |
| B. | 最高正价与最低负价之和为 0 的元素只有 W | |
| C. | 原子半径顺序为:r(W)>r(Q)>r(Y)>r(X) | |
| D. | X、Y、Q 三元素形成的分子中,原子最外层电子数之和最大为 32 |
6.下列反应中,水作还原剂的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2F2+2H2O═4HF+O2 | D. | SO2+H2O═H2SO3 |
3.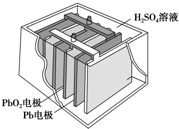 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A. | PbO2是电池的负极 | B. | SO42-向Pb极移动 | ||
| C. | PbO2得电子,被氧化 | D. | 电池放电时,溶液酸性增强 |
18.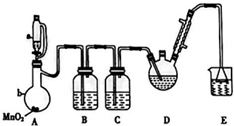 三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
已知:实验室制备三氯乙醛的反应为C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应为C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH+HCl.
回答下列问题:
(1)恒压漏斗a中盛放的试剂是浓盐酸,仪器b的名称是蒸馏烧瓶.
(2)装置B的作用是除去氯气中的氯化氢;若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右;装置E的作用是吸收氯气的尾气,防止环境污染.
(3)反应结束后,有同学提出先将装置D中的混合物冷却到室温,再用分液的方法分高出C2H5Cl,此方案不可行(填“可行”或“不可行”),理由是CCl3COOH溶于乙醇与CCl3CHO.
(4)测定产品纯度的方法如下,称取产品0.36g,配成待测溶液,加入20.00mL0.1000mol•L-1标准碘溶液,再加入适量Na2CO3溶液,反应完全后,加入盐酸调节溶液的pH,立即用0.02000 mol•L-1的Na2S2O3溶液滴定至终点,进行平行实验后,测得消耗Na2S2O3溶液20.00mL,滴定的反应原理为CCl3CHO+OH-→CHCl3+HCOO-;HCOO-+I2→H++2I-+CO2↑;I2+2S2O32-═2I-+S2Cl-.则产品的纯度为73.75%%.
(5)设计实验证明三氯乙酸是弱酸是:分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性比乙酸的强.
 三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:| 物质 | C2H5OH | CCl3CHO | CCl3COOH | C6H5Cl |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
回答下列问题:
(1)恒压漏斗a中盛放的试剂是浓盐酸,仪器b的名称是蒸馏烧瓶.
(2)装置B的作用是除去氯气中的氯化氢;若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右;装置E的作用是吸收氯气的尾气,防止环境污染.
(3)反应结束后,有同学提出先将装置D中的混合物冷却到室温,再用分液的方法分高出C2H5Cl,此方案不可行(填“可行”或“不可行”),理由是CCl3COOH溶于乙醇与CCl3CHO.
(4)测定产品纯度的方法如下,称取产品0.36g,配成待测溶液,加入20.00mL0.1000mol•L-1标准碘溶液,再加入适量Na2CO3溶液,反应完全后,加入盐酸调节溶液的pH,立即用0.02000 mol•L-1的Na2S2O3溶液滴定至终点,进行平行实验后,测得消耗Na2S2O3溶液20.00mL,滴定的反应原理为CCl3CHO+OH-→CHCl3+HCOO-;HCOO-+I2→H++2I-+CO2↑;I2+2S2O32-═2I-+S2Cl-.则产品的纯度为73.75%%.
(5)设计实验证明三氯乙酸是弱酸是:分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性比乙酸的强.