题目内容
1.已知五种短周期元素的原子半径及主要化合价如表,下列叙述正确的是( )| L | M | Q | R | T | |
| 原子半径 | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 王要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L 和 Q 形成的化合物含极性共价键 | |
| B. | L、R 的单质与盐酸反应速率:R>L | |
| C. | T、Q 的氢化物常温常压下均为无色气体 | |
| D. | M 极易与 T 反应 |
分析 L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg;Q和T的化合价都有-2价,应为周期表第ⅥA族元素,Q的最高价为+6价,应为S元素,T无正价,应为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于S,为Al元素,结合元素周期律知识解答该题.
解答 解:L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg;Q和T的化合价都有-2价,应为周期表第ⅥA族元素,Q的最高价为+6价,应为S元素,T无正价,应为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于S,为Al元素,
A.Mg与S形成MgO,属于离子化合物,不存在极性键,故A错误;
B.L为Mg、R为Be,金属性Mg>Be,则与盐酸反应速率:Mg>Be,故B错误;
C.T为O,对应的氢化物常温下为液体,Q为S,其氢化物为气态硫化氢,故C错误;
D.M为Al,T为O,铝易与氧气反应,故D正确;
故选D.
点评 本题考查元素位置结构性质的关系及应用,为高频考点,题目难度中等,根据元素化合价、原子半径推断元素是解题关键,注意原子结构与元素周期率的把握.

练习册系列答案
相关题目
11.下列有关化学与自然资源的开发利用说法中不正确的是( )
| A. | 海水提镁的过程为:MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| B. | 石油裂化的主要目的是提高汽油等轻质燃油的产量 | |
| C. | 煤干馏的产品很多,属于化学变化 | |
| D. | 海水提溴是将海水中的化合态的溴富集再转化为游离态的溴 |
12.A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而辛是由C元素形成的单质,已知:甲+乙═丁+辛,甲+丙═戊+辛;丁由两种10电子粒子形成,则下列说法正确的是( )
| A. | 元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键 | |
| B. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B) | |
| C. | 往1.0 L 0.1 mol•L-1戊溶液中逐滴滴入同浓度的盐酸,立即产生大量气泡 | |
| D. | 1 mol甲与足量的乙完全反应共转移约1.204×l024个电子 |
9.下列离子中,电子数大于质子数,且质子数大于中子数的是( )
| A. | OH- | B. | Mg2+ | C. | OD- | D. | D3O+ |
16.试推测第 82 号元素 X 的单质及其化合物不可能具有的性质( )
| A. | X 的氧化物的水化物可能有两种 | B. | .单质是能导电的固体 | ||
| C. | 单质不能与氢气直接化合 | D. | X 是非金属元素 |
6.下列反应中,水作还原剂的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2F2+2H2O═4HF+O2 | D. | SO2+H2O═H2SO3 |
13.电解冶炼铝时使用了助熔剂Na3AlF6,在电解槽中存在电解质W2[X2Y2Z4],Y原子最外层电子数为次外层的3倍,X原子最外层电子数为Y原子最外层电子数的一半.下列说法正确的是( )
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:W>X>Y>Z | ||
| C. | W的最高价氢氧化物的碱性比X弱 | D. | Y的最简单氢化物的稳定性比Z的强 |
10.某聚酯纤维结构如下: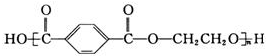 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 由单体合成该聚酯纤维的反应属于加聚反应 | |
| B. | 该聚酯纤维不能水解 | |
| C. | 该聚酯纤维单体为对苯二甲酸和乙二醇 | |
| D. | 该聚酯纤维含有亲水基羟基,在水中溶解度较大 |