题目内容
19.在硫化钠溶液中存在的下列关系不正确的是( )| A. | C(Na+)=2C(S2-)+2C(HS-)+2C(H2S) | B. | C(Na+)+C(H+)=C(OH-)+C(HS-)+C(S2-) | ||
| C. | C(OH-)=C(H+)+C(HS-)+2(H2S) | D. | C(Na+)>C(S2-)>C(OH-)>C(HS-) |
分析 A、根据物料守恒分析解答;
B、根据电荷守恒分析解答;
C、根据质子守恒分析解答;
D、Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,且硫离子第一步水解程度远远大于第二步水解程度;
解答 解:A、根据物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),故A正确;
B、该物质溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故B错误;
C、根据物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),所以得c(OH-)=c(HS-)+c(H+)+2c(H2S),故C正确;
D、Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,且硫离子第一步水解程度远远大于第二步水解程度,硫离子两步水解和水电离都生成氢氧根离子,硫离子第一步水解生成硫氢根离子,所以该溶液中离子浓度大小顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故D正确;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确盐的类型及水解程度是解本题关键,注意电荷守恒和物料守恒的灵活运用,题目难度不大.

练习册系列答案
相关题目
10.下列有关钠单质及其化合物的说法错误的是( )
| A. | Na2O2可用作呼吸面具的供氧剂 | |
| B. | 侯德榜“联合制碱法”制取的是碳酸钠 | |
| C. | 钠与乙醇反应,钠块沉入试管底部 | |
| D. | NaHCO3的热稳定性大于Na2CO3 |
7.水体富营养化可导致赤潮、水华等水污染现象.下列与水体富营养化密切相关的元素是( )
| A. | C | B. | O | C. | P | D. | S |
14.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8□反应中,正确的是( )
| A. | Cl2是还原产物 | |
| B. | □处对应的物质为H2O | |
| C. | 氧化剂与还原剂物质的量之比为1:8 | |
| D. | 若1mol KMnO4参加反应,转移的电子的物质的量是4mol |
4.生活环境逐渐恶化,人们日益重视环境问题,下列做法或说法正确的是( )
| A. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| B. | PM2.5是指大气中直径接近于2.5μm(1m=106μm=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| C. | 为提高农作物产量大量使用农药和化肥 | |
| D. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 |
11.下列有关说法正确的是( )
| A. | 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 | |
| B. | 新戊烷的二氯代物有2种 | |
| C. | 分子式为C2H4和C4H8的物质一定互为同系物 | |
| D. | 键线式为  的有机物的分子式为C8H10 的有机物的分子式为C8H10 |
8.随着科技的不断进步,15N、N70、N5+、NH5等已被发现.下列有关说法中,正确的是( )
| A. | 15N中含有7个中子 | |
| B. | N2和N70属于同位素 | |
| C. | N5+中含有36个电子 | |
| D. | 若NH5为离子化合物,则其既含有离子键,又含有共价 |
18.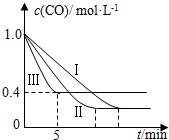 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol.
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1的影响,某活动小组设计了三个实验,实验曲线如图所示
①请依据实验曲线图补充完整表格中的实验条件:X=530℃,Y=5MPa.
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、0.1mol CO2(g)、0.1mol H2(g),此时化学反应将正向(填“正向”、“逆向”或“不”) 移动.
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol.
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1的影响,某活动小组设计了三个实验,实验曲线如图所示
| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、0.1mol CO2(g)、0.1mol H2(g),此时化学反应将正向(填“正向”、“逆向”或“不”) 移动.
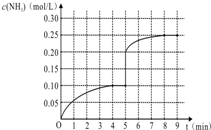 在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: