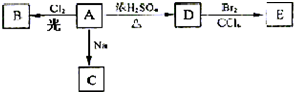
题目内容
某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验,回答下列问题:

(1)写出A装置(图1)中玻璃仪器的名称:酒精灯、 、 .
(2)实验开始后,写出B中反应的离子方程式 .
(3)C中的现象是 ,E装置的作用是 .
(4)某学生按图2所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应.然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g.请你计算原样品中Na2SO3的纯度为 (精确到0.1%).
(5)在过滤沉淀时若滤液出现浑浊,则必须要重复操作,若该学生没有重复过滤,则测定的结果将 (填“偏高”、“偏低”或“无影响”).
(6)要使测定结果准确,第一:装置气密性必须良好;第二:应先点燃 处酒精灯(填装置字母).

(1)写出A装置(图1)中玻璃仪器的名称:酒精灯、
(2)实验开始后,写出B中反应的离子方程式
(3)C中的现象是
(4)某学生按图2所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应.然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g.请你计算原样品中Na2SO3的纯度为
(5)在过滤沉淀时若滤液出现浑浊,则必须要重复操作,若该学生没有重复过滤,则测定的结果将
(6)要使测定结果准确,第一:装置气密性必须良好;第二:应先点燃
考点:探究物质的组成或测量物质的含量
专题:
分析:A装置产生二氧化硫,D装置产生氯气在F装置中干燥,C装置检验干燥氯气的漂白性,氯气和二氧化硫在B装置中反应,E装置吸收尾气,防止污染空气.
(1)根据装置图填写仪器名称;
(2)A为实验室制备二氧化硫的发生装置,D为实验室制备氯气的发生装置,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸;
(3)红色鲜花中含水,水和氯气反应生成盐酸和次氯酸,次氯酸具有漂白作用;氯气和二氧化硫有毒,E中NaOH溶液吸收尾气防止污染;
(4)根据图示读取样品质量,根据硫元素守恒计算,Na2SO3~SO2~BaSO4;
(5)没有重复过滤,导致部分沉淀留在滤液中,导致硫酸钡质量减少;
(6)应先准备氯气,保证二氧化硫被完全氧化.
(1)根据装置图填写仪器名称;
(2)A为实验室制备二氧化硫的发生装置,D为实验室制备氯气的发生装置,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸;
(3)红色鲜花中含水,水和氯气反应生成盐酸和次氯酸,次氯酸具有漂白作用;氯气和二氧化硫有毒,E中NaOH溶液吸收尾气防止污染;
(4)根据图示读取样品质量,根据硫元素守恒计算,Na2SO3~SO2~BaSO4;
(5)没有重复过滤,导致部分沉淀留在滤液中,导致硫酸钡质量减少;
(6)应先准备氯气,保证二氧化硫被完全氧化.
解答:
解:(1)解:装置中所用玻璃仪器为:圆底烧瓶、分液漏斗和酒精灯,故答案为:圆底烧瓶、分液漏斗;
(2)D为实验室制备氯气的发生装置,反应为:MnO2+4HCl(浓)
MnCl2+Cl2↑2H2O,A中是实验室制备二氧化硫的装置,反应的化学方程式为:H2SO4+Na2SO3═Na2SO4+H2O+SO2↑,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
故答案为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
(3))红色鲜花中含水,水和氯气反应生成盐酸和次氯酸,次氯酸具有漂白作用,故红色鲜花褪色;氯气和二氧化硫有毒,二氧化硫在溶液中反应生成亚硫酸钠和水,反应的离子方程式为:SO2+2OH-═SO32-+H2O;氯气在其溶液中反应生成NaCl和NaClO,反应为:Cl2+2OH-═Cl-+ClO-+2H2O,故E中NaOH溶液吸收尾气防止污染;
故答案为:红色鲜花褪色;吸收未反应的二氧化硫和氯气;
(4)根据硫元素守恒计算,
Na2SO3~SO2~BaSO4
126g 233g
m 23.3g
m=
=12.6g,
样品质量为:10.0g+10.0g+5.0g-0.2g=24.8g,
所以Na2SO3的质量分数为
×100%=50.8%;
故答案为:50.8g;
(5)没有重复过滤,导致部分沉淀留在滤液中,导致硫酸钡质量减少,则由此计算的亚硫酸钠的质量减少,质量分数偏低,故答案为:偏低;
(6)应先准备氯气,保证二氧化硫被完全氧化,故先加热D处酒精灯,故答案为:D.
(2)D为实验室制备氯气的发生装置,反应为:MnO2+4HCl(浓)
| ||
故答案为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
(3))红色鲜花中含水,水和氯气反应生成盐酸和次氯酸,次氯酸具有漂白作用,故红色鲜花褪色;氯气和二氧化硫有毒,二氧化硫在溶液中反应生成亚硫酸钠和水,反应的离子方程式为:SO2+2OH-═SO32-+H2O;氯气在其溶液中反应生成NaCl和NaClO,反应为:Cl2+2OH-═Cl-+ClO-+2H2O,故E中NaOH溶液吸收尾气防止污染;
故答案为:红色鲜花褪色;吸收未反应的二氧化硫和氯气;
(4)根据硫元素守恒计算,
Na2SO3~SO2~BaSO4
126g 233g
m 23.3g
m=
| 126g×23.3g |
| 233g |
样品质量为:10.0g+10.0g+5.0g-0.2g=24.8g,
所以Na2SO3的质量分数为
| 12.6g |
| 24.8g |
故答案为:50.8g;
(5)没有重复过滤,导致部分沉淀留在滤液中,导致硫酸钡质量减少,则由此计算的亚硫酸钠的质量减少,质量分数偏低,故答案为:偏低;
(6)应先准备氯气,保证二氧化硫被完全氧化,故先加热D处酒精灯,故答案为:D.
点评:本题考查实验基本操作、二氧化硫和氯气的性质,较基础,注意从实验目的考虑加热的先后顺序,

练习册系列答案
相关题目
将8.7g MnO2粉末与含14.6gHCl的浓盐酸共热,完全反应后,生成的氯气体积(标准状况)( )
| A、等于4.48L |
| B、等于2.24L |
| C、介于2.24~4.48L |
| D、小于2.24L |
若液氨相当于地球上的水,它可满足本星上生物生存的需要,那么木星上生物体内与地球上生物体内葡萄糖的分子结构相当的化合物是( )
| A、CH2NH2-(CHNH2)4CH=NH |
| B、CH2NH3-(CHNH2)4CHO |
| C、CH2OH-(CHOH)4 CHO |
| D、CH2OH-(CHOH)4 CH=NH |
 某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol?L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液.发生的反应为:
某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol?L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液.发生的反应为: 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.