题目内容
14. 蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在.
蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在.(1)在蛋白质中涉及的氮、氧元素电负性由小到大的顺序是N<O;基态硫原子的价电子排布式为3s23p4.
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为CO2或N2O等(填化学式).1mol CN-中含有的π键的数目为2×6.02×1023.
(3)蛋白质分子中氨基(-NH2)氮原子的轨道杂化类型是sp3;血液中有一种含铜的呈蓝色的蛋白质分子,与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
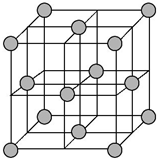
(4)铜晶体为面心立方最密堆积,即在晶体结构中可以分割出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个面上,已知铜的原子半径为127.8pm,列式计算晶体铜的密度:ρ=$\frac{4×64}{{N}_{A}(2\sqrt{2}×127.8×1{0}^{-10})^{3}}$g•cm-3(列出计算式即可).
分析 (1)非金属性越强,电负性越大;S元素处于第三周期VIA族;
(2)与SCN-互为等电子体,应含有3个原子,且最外层电子数相同; CN-与N2互为等电子体,二者结构相似,故 CN-离子中形成C≡N三键;
(3)蛋白质分子中氨基(-NH2)氮原子形成3个σ键,含有1对孤对电子,N原子杂化轨道数目为4;与Cu同周期且最外层电子数相等的元素原子外围电子排布为4s1、3d54s1;
(4)晶胞为面心立方密堆积,晶胞面对角线上的Cu原子相邻,则晶胞棱长为127.8pm×4×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$×127.8pm,根据均摊法计算晶胞中Cu原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)非金属性越强,电负性越大,故电负性:N<O;S元素处于第三周期VIA族,基态硫原子的价电子排布式为3s23p4,
故答案为:N<O;3s23p4;
(2)与SCN-互为等电子体,应含有3个原子,且最外层电子数相同,故为CO2或N2O等; CN-与N2互为等电子体,二者结构相似,故 CN-离子中形成C≡N三键,1mol CN-中含有的π键的数目为2×6.02×1023,
故答案为:CO2或N2O等;2×6.02×1023;
(3)蛋白质分子中氨基(-NH2)氮原子形成3个σ键,含有1对孤对电子,N原子杂化轨道数目为4,N原子轨道的杂化类型是sp3,
与Cu同周期且最外层电子数相等的元素原子外围电子排布为4s1、3d54s1,分别为K、Cr,
故答案为:sp3;K、Cr;
(4)晶胞为面心立方密堆积,晶胞面对角线上的Cu原子相邻,则晶胞棱长为127.8pm×4×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$×127.8pm,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{64}{{N}_{A}}$g,则晶胞密度4×$\frac{64}{{N}_{A}}$g÷($\sqrt{2}$×127.8×10-10 cm)3=$\frac{4×64}{{N}_{A}(2\sqrt{2}×127.8×1{0}^{-10})^{3}}$g•cm-3,
故答案为:$\frac{4×64}{{N}_{A}(2\sqrt{2}×127.8×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、等电子体、化学键杂化方式、晶胞计算等,(4)中关键是明确原子半径与晶胞边长关系,掌握均摊法进行晶胞有关计算.

| A. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化钠溶液中加入足量硝酸银溶液:Ag++Cl-=AgCl↓ | |
| D. | 氯化铁溶液中加入氢氧化钠溶液:Fe3++3OH-=Fe(OH)3↓ |
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2、sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶
胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |

(2)ACl2分子中A的杂化类型为sp杂化.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确否,并阐述理由C60为分子晶体,熔化时破坏的是范德华力,无需破坏共价键,而金刚石属于原子晶体,熔化时需要破坏共价键.
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.写出基态钾原子的价电子排布式4s1,该物质的K原子和C60分子的个数比为3:1.

(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si,NCl3分子的空间构型为三角锥形.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 2.5mol |
 原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.
原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子. 图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为O、Si(填元素符号).
图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为O、Si(填元素符号).