题目内容
7.下列叙述中不正确的是( )| A. | 含离子键的化合物一定是离子化合物 | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | 含共价键的化合物不一定是共价化合物 | |
| D. | 在离子化合物中也可能含有共价键 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,含离子键的一定为离子化合物,离子化合物中可含共价键,以此来解答.
解答 解:A.含离子键的化合物一定是离子化合物,如NaCl、NaOH均一定含离子键,故A正确;
B.非金属元素形成的化合物可能为离子化合物,如铵盐,故B错误;
C.含共价键的化合物可能为离子化合物,如NaOH、NaClO等,故C正确;
D.在离子化合物中也可能含有共价键,如NaOH含离子键、共价键,故D正确;
故选B.
点评 本题考查离子化合物,为高频考点,把握化学键的形成及化合物的类别为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
16.NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A. | 1molNa2O2与足量二氧化碳反应转移的电子数为2 NA | |
| B. | 标准状况下22.4L CCl4所含的原子数为5NA | |
| C. | 56g Fe与任何物质完全反应时转移的电子数一定为2NA | |
| D. | 1mol镁与足量氧气或氮气反应均失去2NA的电子 |
18.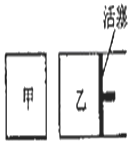 在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2S03(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为b%,乙容器中SO2的转化率为a%,则a与b的关系为( )
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2S03(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为b%,乙容器中SO2的转化率为a%,则a与b的关系为( )
 在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2S03(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为b%,乙容器中SO2的转化率为a%,则a与b的关系为( )
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2S03(g)并达到平衡.在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为b%,乙容器中SO2的转化率为a%,则a与b的关系为( )| A. | 无法确定 | B. | a<b | C. | a=b | D. | a>b |
15.下列物质的电子式或结构式书写正确的是( )
| A. | 氯化铵的电子式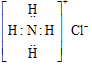 | B. | 氮气的电子式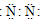 | ||
| C. | 次氯酸的结构式H-Cl-O | D. | 氯化钙的电子式 |
2.下列叙述正确的是( )
| A. | 若AgCl沉淀完全,就是指氯化银溶液中溶质离子的浓度为零 | |
| B. | 达到溶解平衡时,晶体就不再溶解 | |
| C. | 室温下,在100g水中能溶解1~10g的溶质,这种物质被称为可溶性物质 | |
| D. | 无机酸都是可溶的 |
19.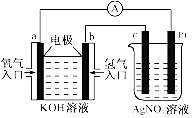 由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
 由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )| A. | 该装置中Pt极为阳极 | |
| B. | 当c极的质量变化了2.16g时,a极上消耗的O2在标准状况下的体积为1.12L | |
| C. | 该装置中b极的电极反应式是:H2+2OH--2e-=2H2O | |
| D. | 该装置中a极为正极,发生氧化反应 |
17.纯碱和小苏打都是白色晶体,在日常生活中都可以找到.通过家庭小实验将它们区分开来,下列方法可行的是( )
| A. | 将它们溶解,观察溶液颜色 | |
| B. | 分别放在炒锅中加热观察是否有残留固物 | |
| C. | 分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧观察火焰颜色 | |
| D. | 取相同质量的样品分别加入等体积的白醋观察反应的剧烈程度 |



