题目内容
17.纯碱和小苏打都是白色晶体,在日常生活中都可以找到.通过家庭小实验将它们区分开来,下列方法可行的是( )| A. | 将它们溶解,观察溶液颜色 | |
| B. | 分别放在炒锅中加热观察是否有残留固物 | |
| C. | 分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧观察火焰颜色 | |
| D. | 取相同质量的样品分别加入等体积的白醋观察反应的剧烈程度 |
分析 A.碳酸钠和碳酸氢钠都易溶于水并且都是无色溶液;
B.碳酸氢钠受热分解生成碳酸钠;
C.焰色反应为元素性质;
D.碳酸钠与醋酸反应先生成碳酸氢钠,碳酸氢钠再与醋酸反应生成二氧化碳.
解答 解:A.碳酸钠和碳酸氢钠都易溶于水,并且都是无色溶液,所以不能区分二者,故A错误;
B.碳酸氢钠受热分解生成碳酸钠,碳酸钠性质稳定,所以纯碱和小苏打分别放在炒锅中加热,都会有残留物,不能区分二者,故B错误;
C.碳酸钠和碳酸氢钠都含有钠元素,灼烧都产生黄色火焰,不能区分二者,故C错误;
D.碳酸钠与醋酸反应先生成碳酸氢钠,碳酸氢钠再与醋酸反应生成二氧化碳,所以碳酸氢钠与醋酸反应剧烈,可以鉴别二者,故D正确;
故选:D.
点评 本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,把握Na2CO3和NaHCO3性质是解题关键,题目难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案
相关题目
7.下列叙述中不正确的是( )
| A. | 含离子键的化合物一定是离子化合物 | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | 含共价键的化合物不一定是共价化合物 | |
| D. | 在离子化合物中也可能含有共价键 |
8.下列物质属于共价化合物的是( )
| A. | MgCl2 | B. | CO2 | C. | Al2O3 | D. | Ca(NO3)2 |
5.下列图示与应叙述相符的是( )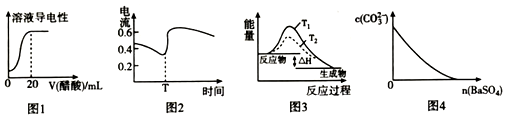

| A. | 图1表示向20mL0.lmol•L-l氯水中逐滴加入0.lmol•L-1醋酸,溶液导电性随加入酸体积的变化 | |
| B. | 图2表示酸性介质Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了 H2O2 | |
| C. | 图3表示S02与O2反应过程中的能量变化,其中T1>T2 | |
| D. | 图4表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c( CO32-)的浓度变化 |
2.下列除去有关物质中杂质(括号内的物质为杂质)的方案中,正确的是( )
| 选项 | 物质 | 除去杂质使用的试剂 | 除去杂质的方法 |
| A | CO2气体(HC1气) | 饱和Na2CO3溶液,浓硫酸 | 洗气 |
| B | NH4Cl固体(I2) | 加热 | |
| C | FeCl2溶液(FeCl3) | 氯水 | |
| D | MgCl2溶液(A1C13) | NaOH溶液,稀盐酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
6.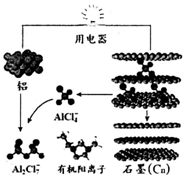 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,电子山石墨电极经用电器流向铝电极 | |
| B. | 充电时,铝电极上发生氧化反应 | |
| C. | 充电时,AlCI4-向铝电极方向移动 | |
| D. | 放电时,负极反应为:Al-3e-+7 AlCl4-═4A12C17- |
2.N2和CH4组成的混合气体,相同条件下其相对于H2的密度为12,则混合气体中N2和CH4的体积比为( )
| A. | 1:1 | B. | 4:1 | C. | 1:4 | D. | 8:7 |