题目内容
20.用20g NaOH配制成500mL溶液,其物质的量浓度为1mol•L-1,从中取出1mL,其物质的量浓度为1mol•L-1,含溶质0.04g.若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为0.01mol•L-1.分析 根据c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$计算溶液物质的量浓度;溶液具有均一性,溶液浓度与溶液体积无关;取出的溶液体积是原溶液体积的$\frac{1}{500}$,则这1mL溶液中溶质的质量是原溶质质量的$\frac{1}{500}$,溶液稀释前后溶质的物质的量不变,据此计算稀释后溶液物质的量浓度.
解答 解:c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$=$\frac{\frac{20g}{40g/mol}}{0.5L}$=1mol/L;溶液具有均一性,溶液浓度与溶液体积无关,所以取出溶液浓度为1mol/L;取出的溶液体积是原溶液体积的$\frac{1}{500}$,则这1mL溶液中溶质的质量是原溶质质量的$\frac{1}{500}$,则取出溶液中溶质的质量=20g×$\frac{1}{500}$=0.04g,溶液稀释前后溶质的物质的量不变,稀释后溶液物质的量浓度=$\frac{1mol/L×0.001L}{0.1L}$=0.01mol/L,
故答案为:1;1;0.04;0.01.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查学生分析计算能力,明确溶液浓度特点及物质的量有关公式是解本题关键,题目难度不大.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
7.下列离子方程式正确的是( )
| A. | 氢氧化钠溶液与稀盐酸反应:H++OH-=H2O | |
| B. | 铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 碳酸钠溶液与稀盐酸反应:Na2CO3+2H+=2Na++H2O+CO2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
11.下列说法正确的是( )
| A. | 胶体与其他分散系最本质的区别是分散质粒子的直径介于1-100 nm之间 | |
| B. | 胶体和溶液都一定是均一透明的分散系,可以用丁达尔效应来鉴别 | |
| C. | 制备Fe(OH)3胶体的操作为,在沸水中逐滴滴加5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色沉淀,停止加热 | |
| D. | 用过滤的方法可以将胶体和溶液分离 |
5.下列溶液中,Cl-的物质的量浓度与50mL 1mol•L-1AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A. | 75mL 2mol•L-1FeCl3溶液 | B. | 25mL 2mol•L-1KCl溶液 | ||
| C. | 150mL 1mol•L-1NaCl溶液 | D. | 20mL 1.5mol•L-1 MgCl2溶液 |
12.(1)砷原子核外电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道).
(3)H2S和H2O2的主要物理性质比较如表:
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因H2O2分子之间会形成氢键,所以熔沸点高,H2O2与水分子之间会形成氢键,所以溶解度大.
(4)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、范德华力.
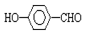 的沸点比
的沸点比 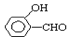 高,原因是:
高,原因是: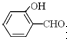 形成分子内氢键,而
形成分子内氢键,而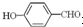 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.
(5)H+可与H2O形成H3O+,H3O+中O原子采用sp3杂化.H3O+中H-O-H键角比H2O中H-O-H键角大,原因为H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
(6)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaO晶胞体积为$\frac{224}{a{N}_{A}}$cm3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道).
(3)H2S和H2O2的主要物理性质比较如表:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(4)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、范德华力.
 的沸点比
的沸点比  高,原因是:
高,原因是: 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.(5)H+可与H2O形成H3O+,H3O+中O原子采用sp3杂化.H3O+中H-O-H键角比H2O中H-O-H键角大,原因为H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
(6)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaO晶胞体积为$\frac{224}{a{N}_{A}}$cm3.
9.今有一种固体化合物X,X本身不导电,但熔融状态和溶于水时能够电离,下列关于X的说法中,不正确的是( )
| A. | X一定为电解质 | B. | X可能为NaCl | ||
| C. | X不能是酸类 | D. | X可以是任何化合物 |
 已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,
已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol, 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: