题目内容
12.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 在46 gN02和N204的混合物气体中所含原子总数为3NA个 | |
| B. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| C. | 2.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.04NA | |
| D. | 7.8g过氧化钠与足量CO2反应,转移电子数为0.2NA,CO2为还原剂 |
分析 A、N02和N204的最简式均为NO2;
B、求出铁的物质的量,然后根据0.1mol在0.1mol氯气中燃烧时铁过量来分析;
C、铜只能与浓硫酸反应,与稀硫酸不反应;
D、求出过氧化钠的物质的量,然后根据过氧化钠与二氧化碳的反应为歧化反应来分析.
解答 解:A、N02和N204的最简式均为NO2,故46g混合物中含有的NO2的物质的量为n=$\frac{46g}{46g/mol}$=1mol,故含3mol原子即3NA个,故A正确;
B、5.6g铁的物质的量为0.1mol,而0.1mol在0.1mol氯气中燃烧时铁过量,而反应后氯元素为-1价,故0.1mol氯气转移0.2mol电子即0.2NA个,故B错误;
C、铜只能与浓硫酸反应,与稀硫酸不反应,故硫酸不能反应完全,则转移的电子的个数小于0.04NA个,故C错误;
D、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠与二氧化碳的反应为歧化反应,二氧化碳不参与氧化还原反应,0.1mol过氧化钠转移0.1mol电子即0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.26g锌和含63gHNO3的稀硝酸正好完全反应,生成的还原产物的相对分子质量可能是( )
| A. | 80 | B. | 30 | C. | 46 | D. | 28 |
7.实验室制取氢氧化铝,最好选用( )
| A. | 铝与氢氧化钠溶液反应 | B. | 铝与水反应 | ||
| C. | 氯化铝溶液与氢氧化钠溶液反应 | D. | 氯化铝溶液与氨水反应 |
17.下列变化过程中,没有发生氧化还原反应的是( )
| A. | 钻木取火 | |
| B. | 青铜器生锈 | |
| C. | 焰色反应检验Na+ | |
| D. | 2015年9月3日,中国在抗日战争暨世界反法西斯战争胜利70周年之际,燃放烟花爆竹,举国欢庆 |
4.下列的叙述中,不正确的是( )
| A. | SO2的摩尔质量是64 g/mol | |
| B. | 常温常压下,64 g SO2中所含的原子数为3×6.02×1023 个 | |
| C. | 1 mol SO3的质量是80 g | |
| D. | 标准状况下,1 mol SO3的体积为22.4 L |
1.在298K、1.01×105Pa下,将22g CO2缓慢通入750mL 1mol•L-1NaOH溶液中充分反应后,测得反应放热为x kJ.已知该条件下,1mol CO2缓慢通入1L 2mol•L-1NaOH溶液中充分反应后放热为y kJ.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
| A. | CO2 (g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2 (g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2 (g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | 2CO2 (g)+2NaOH(aq)═2NaHCO3(aq)△H=-(8x-y) kJ•mol-1 |
2.如图装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过了0.02mol电子,若不考虑溶液体积的变化,下列叙述中正确的是( )
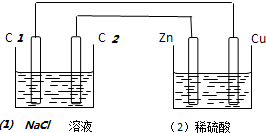

| A. | (1)中C2电极反应式为:2Cl--2e-═Cl2 | B. | (2)溶液中的SO42-向Cu极定向移动 | ||
| C. | (1)中滴入酚酞试液,C1极附近先变红 | D. | (2)中溶液的PH=1 |