题目内容
2.如图装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过了0.02mol电子,若不考虑溶液体积的变化,下列叙述中正确的是( )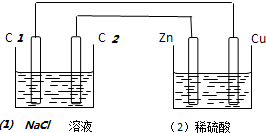
| A. | (1)中C2电极反应式为:2Cl--2e-═Cl2 | B. | (2)溶液中的SO42-向Cu极定向移动 | ||
| C. | (1)中滴入酚酞试液,C1极附近先变红 | D. | (2)中溶液的PH=1 |
分析 能自发的进行氧化还原反应,所以为原电池,则(2)为原电池,锌易失电子作负极,铜作正极,连接锌的碳棒作阴极,连接铜的碳棒作阳极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,据此分析.
解答 解:(2)能自发的进行氧化还原反应,所以为原电池,则(1)为电解池,锌易失电子作负极,铜作正极,连接锌的碳棒作阴极,连接铜的碳棒作阳极,
A.(1)中C2电极为阴极,阴极上氢离子得电子生成氢气,其反应式为:2H++2e-═H2↑,故A错误;
B.原电池中阴离子向负极移动,所以SO42-向Zn极定向移动,故B错误;
C.(1)中阴极上氢离子放电,导致溶液中氢氧根离子浓度增大,滴入酚酞试液,溶液变红色,即C2极附近先变红,故C错误;
D.测得导线上通过了0.02mol电子,则原电池中正极上消耗的氢离子为0.02mol,所以溶液中剩余的氢离子为0.2L×0.1L×2-0.02mol=0.02mol,则c(H+)=$\frac{0.02mol}{0.2L}$=0.1mol/L,所以pH=1,故D正确;
故选D.
点评 本题考查了原电池和电解池原理,明确原电池和电解池区别是解本题关键,注意各个电极上得失电子,电极反应式的书写是学习难点,难度中等,注意把握电子守恒在计算中的应用.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
12.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在46 gN02和N204的混合物气体中所含原子总数为3NA个 | |
| B. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| C. | 2.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.04NA | |
| D. | 7.8g过氧化钠与足量CO2反应,转移电子数为0.2NA,CO2为还原剂 |
13.关于C+CO2═2CO的反应,下列说法正确的是( )
| A. | 单质C中C的化合价升高,被还原,是氧化剂 | |
| B. | CO2中C的化化合价降低,被氧化,CO2是还原剂 | |
| C. | CO既是氧化产物又是还原产物 | |
| D. | 是化合反应,不是氧化还原反应 |
17.铝--空气电池可用作水下动力电源,其原理如图所示.下列有关铝--空气电池的说法中正确的是( )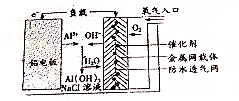

| A. | 电池的负极材料为附着有催化剂的金属网载体 | |
| B. | 电池负极的电极反应为2Cl-2e-═Cl2↑ | |
| C. | 铝电池的电极反应为Al-3e-═Al3+ | |
| D. | 正极的电极反应为O2+4H++4e-═2H2O |
7.下列有关漂白粉的说法正确的是( )
| A. | 漂白粉的有效成分是CaCl2 | |
| B. | 漂白粉和明矾处理自来水的原理是相同的 | |
| C. | 漂白粉最好在弱酸性环境下使用 | |
| D. | 漂白粉因易在空气中氧化而密封保存 |
6.下列离子方程式书写正确的是( )
| A. | 用Pt电极电解少量的MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | H${\;}_{2}^{18}$O中投入Na2O2固体:2H${\;}_{2}^{18}$O+2O${\;}_{2}^{2-}$═4OH-+18O2↑ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | FeSO4溶液中加H2O2溶液:Fe2++2H2O2+4H+═Fe3++4H2O |
7.已知下列反应的热化学方程式:
?6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
?2H2(g)+O2(g)═2H2O(g)△H2
?C(s)+O2(g)═CO2(g)△H3
则反应12CO2(g)+10H2O(g)+O2(g)+6N2(g)═4C3H5(ONO2)3(l)的△H为( )
?6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
?2H2(g)+O2(g)═2H2O(g)△H2
?C(s)+O2(g)═CO2(g)△H3
则反应12CO2(g)+10H2O(g)+O2(g)+6N2(g)═4C3H5(ONO2)3(l)的△H为( )
| A. | 12△H3+5△H2-2△H1 | B. | 2△H1-5△H2-12△H3 | C. | 12△H3-5△H2-2△H1 | D. | △H1-5△H2-12△H3 |