题目内容
5.配制250ml 1.0mol/L NaOH溶液的实验步骤如下:①计算所用NaOH的质量 ②称量 ③溶解 ④冷却,转移、洗涤 摇匀
⑤定容、摇匀 ⑥贴好标签,保存待用.回答下列问题:
(1)所需NaOH的质量是10.0g,
(2)简述第②步的具体操作取小烧杯称其质量后,再增加10g砝码,然后将NaOH加到小烧杯中称量
(3)指出上述操作中的错误并加以改正第⑥步直接贴签保存是错误的,应该将溶液装入细口瓶中,用胶塞盖好保存
(4)判断若出现下列情况对所配制的溶液浓度的影响(填偏大、偏小、无影响)
A.洗净的容量瓶中残留有少量水无影响
B.转移过程中所用的烧杯、玻璃棒未洗涤偏小
C.定容时俯视液面偏大
D.翻转摇匀后发现液面低于刻线又加入少许水调平偏小.
分析 (1)依据m=cVM计算需要氢氧化钠的质量;
(2)氢氧化钠具有强烈的腐蚀性,应放在小烧杯中称量,称量时应先称量小烧杯,再加入药品,砝码增加10.0g,据此解答;
(3)容量瓶不能用来长期盛放溶液,配制完后应倒入细口瓶,用胶塞盖好保存;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制250ml 1.0mol/L NaOH溶液,需要氢氧化钠质量m=1.0mol/L×0.25L×40g/mol=10.0g,故答案为:10.0;
(2)氢氧化钠具有强烈的腐蚀性,应放在小烧杯中称量,正确的操作方法为:取小烧杯称其质量后,再增加10g砝码,然后将NaOH加到小烧杯中称量;
故答案为:取小烧杯称其质量后,再增加10g砝码,然后将NaOH加到小烧杯中称量;
(3)容量瓶不能用来长期盛放溶液,配制完后应倒入细口瓶,用胶塞盖好保存;
故答案为:第⑥步直接贴签保存是错误的,应该将溶液装入细口瓶中,用胶塞盖好保存;
(4)A.洗净的容量瓶中残留有少量水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故答案为:无影响;
B.转移过程中所用的烧杯、玻璃棒未洗涤,导致部分溶质损失,溶质的物质的量偏小,溶液浓度偏小,故答案为:偏小;
C.定容时俯视液面,导致溶液体积偏小,溶液浓度偏大,故答案为:偏大;
D.翻转摇匀后发现液面低于刻线又加入少许水调平,导致溶液体积偏大,溶液浓度偏小,故答案为:偏小.
点评 本题考查了配制一定物质的量浓度的溶液方法,明确配制原理及操作步骤是解题关键,注意依据C=$\frac{n}{V}$进行误差分析的方法,题目难度不大.

练习册系列答案
相关题目
13.在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
(1)下列“鲜花保鲜剂”的成分中,属于电解质的是BCD.
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.1 mol/L.
(3)配制上述“鲜花保鲜剂”用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少500mL容量瓶,胶头滴管(填写所缺仪器的名称).
(4)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液 ⑦定容,
正确的操作顺序是⑤①④⑥③⑦②(填序号).
(5)若定容时俯视容量瓶刻度线,会使所配溶液浓度偏大(填偏大、偏小、不变).
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 1.58 | 158 |
| 硝酸银 | 0.02 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.1 mol/L.
(3)配制上述“鲜花保鲜剂”用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少500mL容量瓶,胶头滴管(填写所缺仪器的名称).
(4)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液 ⑦定容,
正确的操作顺序是⑤①④⑥③⑦②(填序号).
(5)若定容时俯视容量瓶刻度线,会使所配溶液浓度偏大(填偏大、偏小、不变).
11.某学生用0.1032mol•L-1的盐酸标准溶液滴定未知浓度的KOH溶液,其操作分解为如下几步:
A.取已用蒸馏水洗净的酸式滴定管,用盐酸标准溶液润洗滴定管2~3次;
B.移取20mL待测KOH注入洁净的锥形瓶中,并加入2~3滴甲基橙;
C.取标准盐酸溶液注入酸式滴定管至“0”刻度以上1~2cm;
D.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液;
E.调节液面至“0”或“0”以下某一刻度,记录读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记录滴定管液面的刻度.
完成下列问题:
(1)上述操作步骤的正确顺序是ACDEBF(填写字母序号).
(2)判断溶液到达滴定终点的方法是当溶液由黄色变为橙色,且在半分钟内不褪色.
(3)上述A步骤操作的目的是滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低.
(4)若上述B步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果产生的影响是偏高;若称取一定量的KOH固体(含少量NaOH)配制待测溶液并用上述盐酸标准溶液进行滴定,则对滴定结果产生的影响是偏高,理由是因为同质量的NaOH比KOH中和能力强,消耗的盐酸多.
(5)用0.1032mol•L-1的盐酸滴定未知浓度的KOH溶液,重复三次的实验数据如下表所示:
则待测KOH的物质的量浓度是0.1124mol•L-1.
A.取已用蒸馏水洗净的酸式滴定管,用盐酸标准溶液润洗滴定管2~3次;
B.移取20mL待测KOH注入洁净的锥形瓶中,并加入2~3滴甲基橙;
C.取标准盐酸溶液注入酸式滴定管至“0”刻度以上1~2cm;
D.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液;
E.调节液面至“0”或“0”以下某一刻度,记录读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记录滴定管液面的刻度.
完成下列问题:
(1)上述操作步骤的正确顺序是ACDEBF(填写字母序号).
(2)判断溶液到达滴定终点的方法是当溶液由黄色变为橙色,且在半分钟内不褪色.
(3)上述A步骤操作的目的是滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低.
(4)若上述B步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果产生的影响是偏高;若称取一定量的KOH固体(含少量NaOH)配制待测溶液并用上述盐酸标准溶液进行滴定,则对滴定结果产生的影响是偏高,理由是因为同质量的NaOH比KOH中和能力强,消耗的盐酸多.
(5)用0.1032mol•L-1的盐酸滴定未知浓度的KOH溶液,重复三次的实验数据如下表所示:
| 序号 | 消耗盐酸的体积/mL | 待测KOH溶液的体积/mL |
| 1 | 27.23 | 25.00 |
| 2 | 28.24 | 25.00 |
| 3 | 27.25 | 25.00 |
 23个水分子中,含分子数最多的是(填序号,下同)________,含原子数最多的是________,质量最大的是________,体积最小的是______。
23个水分子中,含分子数最多的是(填序号,下同)________,含原子数最多的是________,质量最大的是________,体积最小的是______。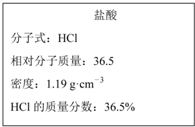 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题: O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为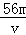 mol/L B.
mol/L B.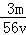 mol/L C.
mol/L C.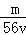 mol/L D.
mol/L D. mol/L
mol/L