题目内容
提纯下列物质(括号内的物质是杂质),请将所选用的除杂试剂和分离方法(填字母或者序号)填入对应的空格中(若不选,填“无”)
除杂试剂:A.盐酸 B.酸性高锰酸钾 C.氢氧化钠溶液 D.(浓)溴水E.H2(催化剂) F.CaO G.NaCl
分离方法:①蒸馏 ②分液 ③洗气 ④过滤
除杂试剂:A.盐酸 B.酸性高锰酸钾 C.氢氧化钠溶液 D.(浓)溴水E.H2(催化剂) F.CaO G.NaCl
分离方法:①蒸馏 ②分液 ③洗气 ④过滤
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| (1) | 酒精(水) | ||
| (2) | 乙烷(乙烯) | ||
| (3) | 硬脂酸钠溶液(甘油) | ||
| (4) | 苯(苯酚) | ||
| (5) | SiO2(Al2O3) |
考点:物质的分离、提纯的基本方法选择与应用,物质的分离、提纯和除杂
专题:实验题
分析:(1)酒精中的水选用CaO和水发生反应然后进行蒸馏的方法;
(2)乙烷中的乙烯除杂的方法可以让混合气体通过溴水,乙烯和溴发生加成反应生成1,2-二溴乙烷存在在溶液中而除去乙烯;
(3)NaCl可以降低甘油在硬脂酸钠溶液的溶解度而除去;
(4)苯酚可以与碱液发生反应生成易溶于水的物质,而苯是难溶于水的,在利用分液的方法除去;
(5)Al2O3是两性物质,而SiO2是酸性氧化物,故可以采用盐酸进行除杂.
(2)乙烷中的乙烯除杂的方法可以让混合气体通过溴水,乙烯和溴发生加成反应生成1,2-二溴乙烷存在在溶液中而除去乙烯;
(3)NaCl可以降低甘油在硬脂酸钠溶液的溶解度而除去;
(4)苯酚可以与碱液发生反应生成易溶于水的物质,而苯是难溶于水的,在利用分液的方法除去;
(5)Al2O3是两性物质,而SiO2是酸性氧化物,故可以采用盐酸进行除杂.
解答:
解:(1)酒精中的水选用CaO和水发生反应,增大沸点差异,然后进行蒸馏①的方法可分离;
(2)乙烷中的乙烯除杂的方法可以让混合气体通过溴水,乙烯和溴发生加成反应生成1,2-二溴乙烷存在在溶液中而除去乙烯,则利用洗气法分离;
(3)选择NaCl可以降低甘油在硬脂酸钠溶液的溶解度而除去,然后过滤④可分离;
(4)苯酚可以与碱液发生反应生成易溶于水的物质,而苯是难溶于水的,在利用分液②的方法除去;
(5)Al2O3是两性物质,而SiO2是酸性氧化物,故可以采用盐酸后过滤故④可除杂,
故答案为:
.
(2)乙烷中的乙烯除杂的方法可以让混合气体通过溴水,乙烯和溴发生加成反应生成1,2-二溴乙烷存在在溶液中而除去乙烯,则利用洗气法分离;
(3)选择NaCl可以降低甘油在硬脂酸钠溶液的溶解度而除去,然后过滤④可分离;
(4)苯酚可以与碱液发生反应生成易溶于水的物质,而苯是难溶于水的,在利用分液②的方法除去;
(5)Al2O3是两性物质,而SiO2是酸性氧化物,故可以采用盐酸后过滤故④可除杂,
故答案为:
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| (1) | 酒精(水) | F | ① |
| (2) | 乙烷(乙烯) | D | ③ |
| (3) | 硬脂酸钠溶液(甘油) | G | ④ |
| (4) | 苯(苯酚) | C | ② |
| (5) | SiO2(Al2O3) | A | ④ |
点评:本题考查混合物分离提纯方法的选择,为高频考点,把握混合物中物质的性质、性质差异为解答的关键,侧重除杂的考查,注意发生的化学反应及除杂原则,题目难度不大.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
 以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O
以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O| 通电 |
| A、在阴极室,随着反应的进行溶液的pH逐渐变小 |
| B、不锈钢电极上生成O2,惰性电极上得到H2 |
| C、惰性电极发生的电极反应为2H2O-4e-═4H++O2↑ |
| D、不锈钢应连接直流电源的正极 |
把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100mL的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后两极收集到的气体在相同条件下体积相同.则下列描述正确的是( )
| A、电路中共转移0.9mol电子 |
| B、阳极得到的气体中有O2且其物质的量为0.35mol |
| C、阴极质量增加3.2g |
| D、若改用铜棒做电极电解该溶液,电极反应不变 |
下列生产、生活、实验中的行为,符合安全要求的是( )
| A、进入煤矿井下作业,戴上安全帽,用帽上的矿灯照明 |
| B、节日期间,可以在热闹繁华的商场里燃放烟花爆竹,欢庆节日 |
| C、点燃打火机,可以检验液化气钢瓶口是否漏气 |
| D、实验室里,可以将水倒入浓硫酸及时用玻璃棒搅拌,配制稀硫酸 |
下列说法中,不正确的是( )
| A、焓变为正值的反应都是吸热反应 |
| B、放热的,熵增加的反应一定能自发进行 |
| C、同一条件下,氨水在不同物质的量浓度的溶液中,其电离程度是不同的 |
| D、强电解质都是离子化合物,弱电解质都是共价化合物 |
用价层电子对互斥理论(VSEPR)可以预测许分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A、C02、CS2、SO2都是直线型的分子 |
| B、COCl2、SF6、CO32-都是平面三角型的分子 |
| C、BF3分子的键角大于CH4分子的键角 |
| D、PCl3、NH3、BCl3都是三角锥形的分子 |
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为ω,物质的量浓度为c mol?L-1.则下列选项不正确的是( )
A、溶质的质量分数为ω=
| ||
| B、用水稀释该溶液,OH- 的物质的量增加 | ||
| C、该溶液中共有6种微粒 | ||
| D、上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5ω |
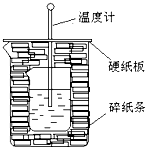 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: