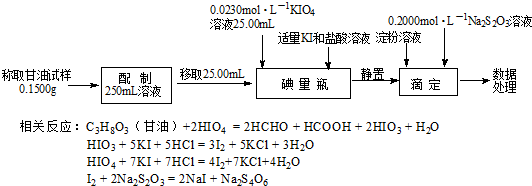
��Ŀ����
9�������仯�����зḻ��ʵĻ�ѧ���ʣ��ش��������⣺��1����Ԫ�������ڱ��е�λ��Ϊ�������ڵڢ��壮
��2��FeCl3��Һ������SO2���÷�Ӧ�����ӷ���ʽ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+��
��3��ij��ѧ��ȤС��ͬѧ��ͼ1װ�ã���ּ��������������壨FeSO4•xH2O������ȫ�ֽ⣮
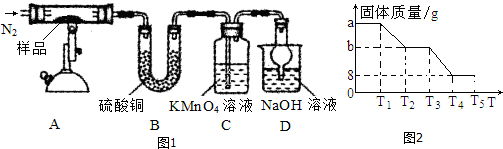
��װ��A�������ͨ��N2����Ŀ���dz������뵪�������ų�װ���еĿ�����������ֽ���������ȫ����A���ų�
�ڳ�ַ�Ӧ��С��ͬѧ�۲쵽��A�в����к���ɫ���壬B�й��������C����Һ��ɫ����д��FeSO4�ֽ�Ļ�ѧ����ʽ��2FeSO4$\frac{\underline{\;\;��\;\;}}{\;}$Fe2O3+SO2��+SO3����
��װ��D�и���ܵ�����Ϊ��ֹ����������Һ������
��С��ͬѧ�ⶨ�˲�ͬ�¶�ʱFeSO4•xH2O�ֽ�������仯������õ���ͼ2��ϵ��ʵ��������װ��B��������9.0g�������ͼ���ݣ�ȷ��FeSO4•xH2O�е�x=5��
���� ��1��Fe��ԭ������Ϊ26��ԭ�ӽṹ����4�����Ӳ㣬����������Ϊ2��
��2��FeCl3��Һ������SO2������������ԭ��Ӧ��
��3�������̿�֪����ͨ�뵪�����ų�װ���еĿ�������ֹ�������ӱ���������A�г�ּ��������������壨FeSO4•xH2O���������ܽ��ֽ�����ų���B������ͭ�ɼ���ˮ��C����Һ��ɫ����֪C�ж��������������ط���������ԭ��Ӧ��Dװ������β����װ��B��������9.0g��Ϊˮ�����������ԭ���غ㼰������ϵ����x���Դ������
��� �⣺��1��Fe��ԭ������Ϊ26��ԭ�ӽṹ����4�����Ӳ㣬����������Ϊ2��λ�����ڱ��е������ڢ��壬�ʴ�Ϊ���ģ�����
��2��FeCl3��Һ������SO2������������ԭ��Ӧ�����ӷ�ӦΪ2Fe3++SO2+2H2O=2Fe2++SO42-+4H+���ʴ�Ϊ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+��
��3�������̿�֪����ͨ�뵪�����ų�װ���еĿ�������ֹ�������ӱ����������ܽ��ֽ�����ų�����A�г�ּ��������������壨FeSO4•xH2O����B������ͭ�ɼ���ˮ��C����Һ��ɫ����֪C�ж��������������ط���������ԭ��Ӧ��Dװ������β����
��װ��A�������ͨ��N2����Ŀ���dz������뵪�������ų�װ���еĿ�����������ֽ���������ȫ����A���ų���
�ʴ�Ϊ���������뵪�������ų�װ���еĿ�����������ֽ���������ȫ����A���ų���
��A�в����к���ɫ���壬B�й��������C����Һ��ɫ����֪���ȷֽ����������������������ԭ�Ӽ������غ��֪����ӦΪ2FeSO4$\frac{\underline{\;\;��\;\;}}{\;}$Fe2O3+SO2��+SO3����
�ʴ�Ϊ��2FeSO4$\frac{\underline{\;\;��\;\;}}{\;}$Fe2O3+SO2��+SO3����
��װ��D�и���ܵ�����Ϊ��ֹ����������Һ�������ʴ�Ϊ����ֹ����������Һ������
��װ��B��������9.0g��Ϊˮ����������ͼ��֪���õ�������Ϊ8g��
��2FeSO4$\frac{\underline{\;\;��\;\;}}{\;}$Fe2O3+SO2��+SO3����FeSO4•xH2O��֪��
Fe2O3��2xH2O
160 36x
8g 9g
$\frac{160}{36x}=\frac{8g}{9g}$�����x=5��
�ʴ�Ϊ��5��
���� ���⿼�����ʵ����ʼ�������ɵIJⶨ��Ϊ��Ƶ���㣬����ʵ��װ�õ����á����ʵ����ʡ����ʻ�ѧʽ���㷽��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�Ѷ��еȣ�

| A�� | P�������� | B�� | ������H2O2��Na2H2P2O6 | ||
| C�� | 1mol H2O2��Ӧ��ת�Ƶ���1mol | D�� | Na2H2P2O6����Ԫ�صĻ��ϼ�Ϊ+3 |
| A�� | ���л�����̼ԭ��������ԭ������γ�4 �����ۼ� | |
| B�� | ��������Ȼ�̼��Һ�ȿ��Լ���������ϩ��Ҳ���Գ�ȥ�����е���ϩ | |
| C�� | ú������ú�����к��б����ױ������ױ����л������ͨ����ȡ�ķ��������ᴿ���� | |
| D�� | �����Ը��������Һ���Լ�����ͼױ� |
| A�� | ��ʯ�ɽ� | B�� | ���㲻�������� | C�� | ��ˮ�ɱ� | D�� | ����ĥ���� |
��̼������Һ������
��ƫ��������Һ������
������������Һ��CO2
����������Һ�백ˮ
���Ȼ�����Һ�백ˮ��
| A�� | �ۢ� | B�� | �٢� | C�� | ���Т� | D�� | �ڢ� |
| A�� | ��ȡ��̼���ڼ�����ʽ | |
| B�� | ���չ涨�������������з������ | |
| C�� | ����ʹ��һ���Կ��ӡ�ֽ�������ϴ��� | |
| D�� | �Ľ�����β���������������ٴ�����Ⱦ����ŷ� |