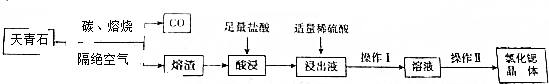
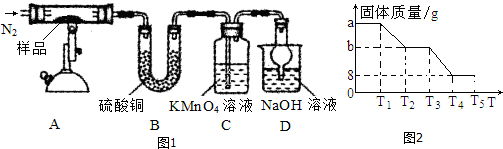
题目内容
15.在标况下,将50mLH2S和60mLO2混合引燃,待反应完全后,恢复至标况下,此时生成SO2的体积为多少mL?分析 根据O2过量时反应为:①2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,O2不足时的反应为:②2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S↓+2H2O判断该反应介于两者之间,设反应①消耗硫化氢的体积为x,反应②中消耗硫化氢体积为y,然后根据硫化氢和氧气的体积列式计算.
解答 解:O2过量时反应为:①2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,O2不足时的反应为:②2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S↓+2H2O,50mLH2S在60mLO2中燃烧,则两个反应都会发生,
设反应①消耗硫化氢的体积为x,反应②中消耗硫化氢体积为y,
则:x+y=50、1.5x+0.5y=60,联立解得:x=35mL、y=15mL,
反应①消耗硫化氢的体积为35mL,则反应生成二氧化硫的体积为35mL,
答:该反应中生成二氧化碳体积为35mL.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
6.你认为减少酸雨产生的途径可采用的措施是:( )
①少用煤作燃料;②把工厂的烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源.
①少用煤作燃料;②把工厂的烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源.
| A. | ①②③ | B. | ②③④ | C. | ①③⑤ | D. | ③④⑤ |
2.化学与社会、生活密切相关,下列有关说法正确的是( )
| A. | 氮化硅陶瓷、有机玻璃是传统无机非金属材料 | |
| B. | 瓷坩埚能耐高温,可以用于加热分解石灰石 | |
| C. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 | |
| D. | SO2具有氧化性,可用于漂白纸浆 |
6.下列叙述正确的是( )
| A. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| B. | 清洁能源所用光电池的生产材料主要是用高纯度的二氧化硅 | |
| C. | 在医疗上氢氧化铝可用于治疗胃酸过多 | |
| D. | 漂白粉在使用时一定要加入一定量的盐酸才能起到漂白作用 |