题目内容
化工生产中通常有“三酸两碱”之说,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.
(1)从物质分类的角度分析,上述说法中不恰当的一种物质是 ,(填化学式).
(2)向盐酸中加入浓H2SO4时,会有白雾生成.下列叙述不属于导致产生该现象的原因的是 (填序号).
A.浓H2SO4具有脱水性 B.盐酸具有挥发性
C.气体溶质的溶解度随温度升高而降低 D.浓硫酸具有吸水性
(3)“三酸”常用于溶解金属和金属氧化物
①下列块状金属在常温下能够全部溶于足量的浓硝酸的是 (填序号);
A.Au B.Ag C.Al D.Fe
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,写出该反应的离子方程式 .
(1)从物质分类的角度分析,上述说法中不恰当的一种物质是
(2)向盐酸中加入浓H2SO4时,会有白雾生成.下列叙述不属于导致产生该现象的原因的是
A.浓H2SO4具有脱水性 B.盐酸具有挥发性
C.气体溶质的溶解度随温度升高而降低 D.浓硫酸具有吸水性
(3)“三酸”常用于溶解金属和金属氧化物
①下列块状金属在常温下能够全部溶于足量的浓硝酸的是
A.Au B.Ag C.Al D.Fe
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,写出该反应的离子方程式
考点:酸、碱、盐、氧化物的概念及其相互联系,硝酸的化学性质,浓硫酸的性质
专题:元素及其化合物
分析:(1)依据酸碱盐的概念和物质组成分析判断,纯碱是盐;
(2)盐酸滴入浓硫酸溶液温度升高,气体氯化氢溶解度减小,挥发到空气中遇水蒸气形成盐酸小液滴分析判断;
(3)①金属与浓硝酸反应时,常温下铁铝发生钝化现象,阻止反应进行;金、铂不和浓硝酸反应;
②过氧化氢酸性溶液中具有氧化性,据此书写方程式.
(2)盐酸滴入浓硫酸溶液温度升高,气体氯化氢溶解度减小,挥发到空气中遇水蒸气形成盐酸小液滴分析判断;
(3)①金属与浓硝酸反应时,常温下铁铝发生钝化现象,阻止反应进行;金、铂不和浓硝酸反应;
②过氧化氢酸性溶液中具有氧化性,据此书写方程式.
解答:
解:(1)碱是溶液中电离出的阴离子全是氢氧根离子的化合物;纯碱为Na2CO3,属于盐,故答案为:Na2CO3;
(2)向盐酸中加入浓H2SO4时,会有白雾生成.是因为浓硫酸溶解过程使溶液温度升高氯化氢挥发在空气中遇到水蒸气形成盐酸小液滴;
A、浓H2SO4具有脱水性不是产生现象的原因,故A正确;
B、产生雾是因为盐酸具有挥发性,挥发出的氯化氢形成,故B错误;
C、气体溶质的溶解度随温度升高而降低,氯化氢挥发,故C错误;
D,浓硫酸具有吸水性,可以做干燥剂,与此现象无关,故D错误;
故选A;
(3)①金属在常温下能够全部溶于足量的浓硝酸的是银,金不反应,铁和铝常温下发生钝化现象反应不再继续,故答案为:B;
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,说明过氧化氢在酸性溶液中具有氧化性溶解铜,
反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O.
(2)向盐酸中加入浓H2SO4时,会有白雾生成.是因为浓硫酸溶解过程使溶液温度升高氯化氢挥发在空气中遇到水蒸气形成盐酸小液滴;
A、浓H2SO4具有脱水性不是产生现象的原因,故A正确;
B、产生雾是因为盐酸具有挥发性,挥发出的氯化氢形成,故B错误;
C、气体溶质的溶解度随温度升高而降低,氯化氢挥发,故C错误;
D,浓硫酸具有吸水性,可以做干燥剂,与此现象无关,故D错误;
故选A;
(3)①金属在常温下能够全部溶于足量的浓硝酸的是银,金不反应,铁和铝常温下发生钝化现象反应不再继续,故答案为:B;
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,说明过氧化氢在酸性溶液中具有氧化性溶解铜,
反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O.
点评:本题考查了物质分类,概念判断,物质性质的综合应用,主要考查酸碱盐的概念判断,金属和酸反应的规律,浓硝酸的特征性质应用,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
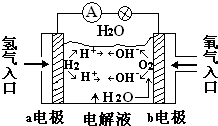 如图为氢氧燃料电池的原理示意图,按照此图的提示,下列叙述中不正确的是( )
如图为氢氧燃料电池的原理示意图,按照此图的提示,下列叙述中不正确的是( )| A、a电极是负极 |
| B、b电极的电极反应式为4OH--4e-=2H2O+O2↑ |
| C、在电池内部,H+向a电极附近运动 |
| D、氢氧燃料电池是一种具有广泛应用前景的绿色电源 |
含相同分子数的CO2和NH3一定具有相同的( )
| A、原子个数 | B、体积 |
| C、质量 | D、物质的量 |
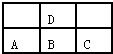 如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )
如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )| A、D与C不能形成化合物 |
| B、D的最高正价与B的最高正价相等 |
| C、A、B、C的最高价氧化物对应的水化物酸性强弱的关系是C>B>A |
| D、A、B、C、D原子所具有的原子轨道类型和数目都相同 |
下列对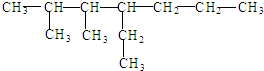 的命名中正确的是( )
的命名中正确的是( )
 的命名中正确的是( )
的命名中正确的是( )| A、2,3-二甲基-4-丙基己烷 |
| B、2,3-二甲基-4-乙基庚烷 |
| C、4-乙基-2,3-二甲基庚烷 |
| D、5,6-二甲基-4-乙基庚烷 |
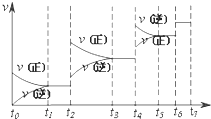 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据: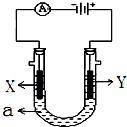 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: