题目内容
14.在恒温恒容的密闭容器中,充入4mol气体A和2mol气体B发生反应:3A(g)+2B(g)?4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,反应前后体系压强之比为5:4.则下列说法正确的是( )| A. | 气体A的平衡转化率大于气体B平衡转化率 | |
| B. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数减小 | |
| C. | 物质D的聚集状态一定是气体 | |
| D. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 |
分析 恒容容器中,气体的压强之比等于气体的物质的量之比,从反应物和生成物的化学计量数和反应前后压强之比可知,C和D中至少有一种物质不是气体,利用三段式法计算出反应后气体物质的量,确定C、D的状态,据此进行解答,
A.充入4mol气体A和2mol气体B发生反应,可以看做先充入3molA和2molB反应达到衡,再加入1molA平衡正向进行,两种反应物增加一种会提高另一种的转化率;
B.平衡常数随温度变化;
C.物质D的聚集状态一定是气体;
D.升温平衡向吸热反应方向进行;
解答 解:反应方程式为:3A(g)+2B(g)?4C(?)+2D(?)
反应前(mol) 4 2 0 0
反应了(mol) 1.2 0.8 1.6 0.8
平衡后(mol) 2.8 1.2 1.6 0.8
由气体物质的量之比等于压强之比可得反应后气体物质的量为$\frac{4}{5}$×(4+2)=4.8mol,所以D为气体、C不是气体,
A.充入4mol气体A和2mol气体B发生反应,可以看做先充入3molA和2molB反应达到衡,再加入1molA平衡正向进行,A的转化率减小,B转化率增大,故A错误;
B.平衡后若减小该体系的压强,则平衡向左移动,但化学平衡常数不变,故B错误;
C.计算分析可知物质D的聚集状态一定是气体,故C正确;
D.平衡后升高温度,若平衡向左移动,逆反应为吸热反应,则正反应为放热反应,反应的△H<0,故D错误;
故选C.
点评 本题考查了平衡计算、转化率、平衡常数的影响因素,题目难度中等,注意掌握化学平衡及其影响因素,气体压强之比等于气体物质的量之比计算分析CD的状态是解题关键.

练习册系列答案
相关题目
20.能正确表示下列反应的离子方程式是( )
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | NaHSO3溶液中通入少量Cl2:HSO3-+Cl2+H2O═3H++SO42-+2Cl- | |
| C. | 氯化钠与浓硫酸混合加热:H2SO4+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+Cl2↑+H2O | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
2.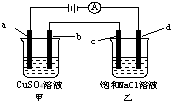 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 当b极增重3.2 g时,d极产生的气体为0.56 L(标准状况) | |
| C. | 当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 甲烧杯中a电极反应式为:4OH--4e-═O2↑+2H2O |
9.下列关于各图象的解释或结论不正确的是( )
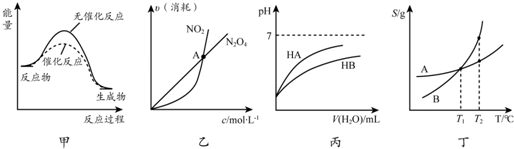

| A. | 由甲可知:使用催化剂不影响反应热 | |
| B. | 由乙可知:对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者 | |
| D. | 由丁可知:将T1℃的A、B饱和溶液升温至T2℃时,A与B溶液的质量分数相等 |
19.在甲、乙、丙三种溶液中各含一种卤素离子,往甲中加淀粉和氯水,则溶液变蓝色,再往丙中加淀粉和氯水,无明显现象.则甲、乙、丙依次含有( )
| A. | Br-、I-、Cl- | B. | I-、Cl-、Br- | C. | I-、Br-、Cl- | D. | Br-、Cl-、I- |
6.西安市环境保护监测中心2015年12月29日9时发布,西安市空气质量指数:233,属重度污染,监测的主要污染物有PM2.5、NO2、SO2、CO、O3等.下列空气污染物与其主要来源不对应的是
( )
| A | B | C | D | |
| 污染物 | 二氧化硫 | 甲醛 | 氮氧化物 | 悬浮颗粒物 |
| 来源 | 雷电时空气中产生 | 人造家具、用具 | 燃煤、汽车尾气 | 燃煤、施工 |
| A. | A | B. | B | C. | C | D. | D |
3.同一温度下,甲溶液的pH是3,乙溶液的pH是5,甲溶液与乙溶液的c(OH-)之比为( )
| A. | 3:5 | B. | 5:3 | C. | 100:1 | D. | 1:100 |
4.下列有关化学用语表述正确的是( )
| A. | 质子数为8的氧原子: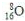 | |
| B. | 漂白粉的有效成分:NaClO | |
| C. | Mg2+结构示意图: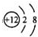 | |
| D. | 钠在氧气中燃烧的化学方程式:4Na+O2 $\frac{\underline{\;点燃\;}}{\;}$2Na2O |