题目内容
5.MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示: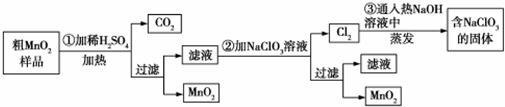
(1)第①步反应中的硫酸能否用浓盐酸代替?否(填“能”或“否”),理由是浓盐酸能被MnO2氧化生成Cl2.
(2)第②步操作中,氧化性强弱顺序:ClO3->MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+;当反应中转移2mol电子时,生成的氧化产物的物质的量为1mol.
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH.
①制取K2MnO4的化学反应方程式为2MnO2+4KOH+O2=2K2MnO4+2H2O,工业上不断搅拌的目的是使反应物与O2充分接触.
②电解K2MnO4的浓溶液时,电解的总反应方程式为2K2MnO4+2H2O═KMnO4+2KOH+H2↑.
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3═2NaI+Na2S4O6
取较为纯净的二氧化锰样品ag加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗VmLNa2S2O3溶液,则该样品中MnO2含量为$\frac{0.435V}{a}$%(杂质不参与反应).
分析 粗MnO2(含有较多的MnO、MnCO3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤得滤液为硫酸锰溶液,加入NaClO3发生反应为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,再过滤得到滤液和二氧化锰固体,而氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,
(1)二氧化锰有氧化性,在加热时浓盐酸能被MnO2氧化生成Cl2,据此答题;
(2)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;操作②中硫酸锰溶液,加入NaClO3发生氧化还原反应生成MnO2、Cl2,根据方程式转移电子数计算生成的氧化产物的物质的量;
(3)①二氧化锰在碱性条件下被氧气氧化可制取K2MnO4,为使二氧化锰能被充分氧化,工业上不断搅拌,使反应物与O2充分接触;
②电解K2MnO4的浓溶液时,生成高锰酸钾和氢气;
(4)根据反应MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O,I2+2Na2S2O3═2NaI+Na2S4O6可得关系式MnO2~2Na2S2O3,根据Na2S2O3的物质的量可计算出二氧化锰的质量,进而确定该样品中MnO2含量.
解答 解:(1)二氧化锰有氧化性,在加热时浓盐酸能被MnO2氧化生成Cl2,所以不能用盐酸代替硫酸,
故答案为:否;浓盐酸能被MnO2氧化生成Cl2;
(2)操作②中硫酸锰溶液,加入NaClO3发生氧化还原反应生成MnO2、Cl2,反应的离子方程式为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,ClO3-作氧化剂,MnO2作氧化产物,则氧化性:ClO3->MnO2;当NaClO3转移2mol电子时,消耗NaClO3为0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:>;5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+;1;
(3)①二氧化锰在碱性条件下被氧气氧化可制取K2MnO4,反应的方程式为2MnO2+4KOH+O2=2 K2MnO4+2H2O,为使二氧化锰能被充分氧化,工业上不断搅拌,使反应物与O2充分接触,
故答案为:2MnO2+4KOH+O2=2 K2MnO4+2H2O;使反应物与O2充分接触;
②电解K2MnO4的浓溶液时,生成高锰酸钾和氢气,电解的总反应方程式为2 K2MnO4+2H2O═KMnO4+2KOH+H2↑,
故答案为:2 K2MnO4+2H2O═KMnO4+2KOH+H2↑;
(4)根据反应MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O,I2+2Na2S2O3═2NaI+Na2S4O6可得关系式MnO2~2Na2S2O3,根据题意可知Na2S2O3的物质的量为0.1000mol/L×0.001VL=0.0001Vmol,所以二氧化锰的质量为0.0001Vmol×87g/mol×$\frac{1}{2}$=0.00435Vg,则该样品中MnO2含量为$\frac{0.00435Vg}{ag}$×100%=$\frac{0.435V}{a}$%,
故答案为:$\frac{0.435V}{a}$.
点评 本题考查物质的分离与提纯方法的综合应用,题目难度中等,把握流程中发生的化学反应及原电池和电解池原理为解答的关键,注意掌握化学实验基本操作方法和根据关系式进行化学计算,试题侧重分析能力及推断能力的考查.

①Na+、H+、SO42-、HCO3-
②K+、Al3+、H2PO4-、HCO3-
③Na+、H+、Cl-、C6H5O-
④H+、Fe2+、NO3-、Cl-
⑤Na+、Al3+、NO3-、AlO2-
⑥Cu2+、Mg2+、SO42-、NO3-.
| A. | ②③⑤ | B. | ①⑥ | C. | ①④⑤ | D. | 只有⑥ |
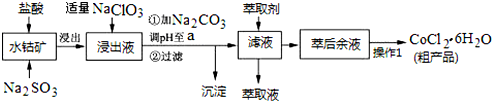
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
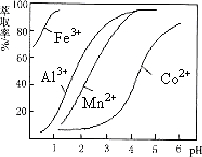
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
| A. | CuCl2 CH3COOH NaOH | B. | HCl H2SO3 NaHCO3 | ||
| C. | HF HCl CH3COONa | D. | NH4Cl HCl CH3COONa |
| A. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 由BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)═2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1②可得反应C(s)+CO2(g)═2CO(g) 的△H=+172.5kJ•mol-1 |
| A. | C10H8和C6H8O3 | B. | C2H2和C6H6 | C. | C2H4和C3H6 | D. | CH4和C2H4 |
| A. | 向FeSO4溶液中通入过量Cl2 | |
| B. | 向NaHCO3溶液中加入一定质量的Na2O2粉末 | |
| C. | 向NaI和NaBr混合溶液中通入过量Cl2 | |
| D. | 向NaOH溶液中加入过量AlCl3(SO4)3 |