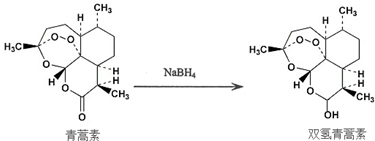
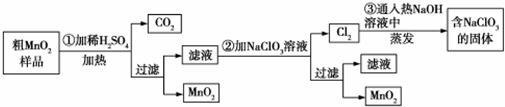
题目内容
15.下列各组离子中,能在水溶液中大量共存,且溶液显酸性的是( )①Na+、H+、SO42-、HCO3-
②K+、Al3+、H2PO4-、HCO3-
③Na+、H+、Cl-、C6H5O-
④H+、Fe2+、NO3-、Cl-
⑤Na+、Al3+、NO3-、AlO2-
⑥Cu2+、Mg2+、SO42-、NO3-.
| A. | ②③⑤ | B. | ①⑥ | C. | ①④⑤ | D. | 只有⑥ |
分析 ①氢离子与碳酸氢根离子反应;
②铝离子与碳酸氢根离子发生双水解反应;
③氢离子与C6H5O-反应生成苯酚;
④硝酸根离子在酸性条件下氧化亚铁离子;
⑤铝离子与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀;
⑥四种离子之间不反应,能够共存.
解答 解:①H+、HCO3-之间发生反应,在溶液中不能大量共存,故①错误;
②Al3+、HCO3-之间发生反应,在溶液中不能大量共存,故②错误;
③H+、C6H5O-之间发生反应生成苯酚,在溶液中不能大量共存,故③错误;
④H+、Fe2+、NO3-之间发生氧化还原反应,在溶液中不能大量共存,故④错误;
⑤Al3+、AlO2-之间发生双水解反应,在溶液中不能大量共存,故⑤错误;
⑥Cu2+、Mg2+、SO42-、NO3-之间不发生反应,在溶液中能够大量共存,故⑥正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
3.aAm+和bBn-核外电子层结构相同,则a值为( )
| A. | b+n-m | B. | b-m-n | C. | b+n+m | D. | b-n+m |
20.生产、生活离不开化学.下列说法正确的是( )
| A. | 淡化海水,可向海水中加入净水剂明矾或Na2FeO4 | |
| B. | 金属钠着火,可用水扑灭 | |
| C. | 在电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收 | |
| D. | 光导纤维属于有机合成新材料 |
4.除去铁粉中少量铝粉,可选用的试剂是( )
| A. | 稀HCl | B. | 稀H2SO4 | C. | NaOH溶液 | D. | NaCl溶液 |



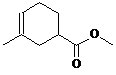 、
、 .
.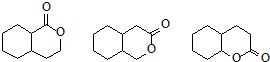 任意一种.
任意一种.