题目内容
5.将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(气)+B?XC(气)+2D(气)五分钟末测得C(D)=0.5mol/L,C(A):C(B)=3:5v(C)=0.1mol/(L•min),求:
(1)A在五分钟末的物质的量
(2)X的值.
分析 利用三段式法解答,先设A、B的物质的量为nmol;
D的浓度为0.5mol/L,所以D的物质的量为1mol.
设A、B的物质的量为nmol,
3A(g)+B(g)=xC(g)+2D(g),
开始:n mol n mol 0 0
反应:1.5mol 0.5mol 1mol
5min:(n-1.5)mol ( n-0.5)mol 1mol
c(A):c(B)=$\frac{(n-1.5)mol}{2L}$:$\frac{(n-0.5)mol}{2L}$=3:5,
所以n=3;
根据D的浓度求出D的反应速率,C、D反应速率之比即为计量数之比.
解答 解:D的浓度为0.5mol/L,所以D的物质的量为1mol.
3A(g)+B(g)=xC(g)+2D(g),
开始:n mol n mol 0 0
反应:1.5mol 0.5mol 1mol
5min:(n-1.5)mol ( n-0.5)mol 1mol
c(A):c(B)=解:D的浓度为0.5mol/L,所以D的物质的量为1mol.
3A(g)+B(g)=xC(g)+2D(g),
开始:n mol n mol 0 0
反应:1.5mol 0.5mol 1mol
5min:(n-1.5)mol ( n-0.5)mol 1mol
c(A):c(B)=$\frac{(n-1.5)mol}{2L}$:$\frac{(n-0.5)mol}{2L}$=3:5,
所以n=3,
(1)有以上分析可知开始时A,B的物质的量都为3mol,则A在5min末的物质的量为(n-1.5)mol=1.5mol,
答:A在5min末的物质的量为1.5mol;
(2)D的浓度为0.5mol/L,反应时间为5min,D的反应速率为0.1mol•L-1•min-1,C的反应速率是0.1mol•L-1•min-1,根据同一反应中,各物质的反应速率之比等于计量数之比,所以x=2;
答:X的值为2.
点评 本题考查化学平衡的计算,题目难度中等,注意化学反应速率计算中常见的错误:1.忽视体积因素,用某物质的物质的量的变化量除以时间的变化量计算;2.用一段时间后某物质的物质的量浓度除以时间的变化量直接计算.

| A. | CH3CH2CH2CH3与CH3CH(CH3)2 | B. | CH3CH═C(CH3)2与CH2═CHCH(CH3)2 | ||
| C. | 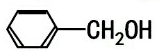 与 与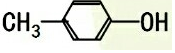 | D. | 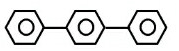 与 与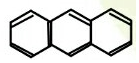 |

| A. | 电极a和电极c都发生氧化反应 | |
| B. | 电极d的电极反应式为2H++2e-=H2↑ | |
| C. | 装置X中通入SO2的速率为2.24L•min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为1.16L•min-1 | |
| D. | 装置X中每消耗64g SO2,理论上装置X和装置Y中均有1mol H+通过质子交换膜 |
| A. | 标准状况下,每生成2.24L O2,转移的电子数一定为0.4NA | |
| B. | 常温下,7.8g苯中所含C-H数位0.6NA | |
| C. | 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA | |
| D. | 25℃时,1.0L PH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| A. | 石英只能用于生产玻璃 | |
| B. | 从海水提取物质不一定要通过化学反应才能实现 | |
| C. | 二氧化硅能与氢氧化钠溶液反应,故常用氢氧化钠溶液作为雕刻玻璃的试剂 | |
| D. | 为了提高土壤肥力,往往将碳铵与熟石灰混合使用 |
| A. | FeCl3溶液得到FeCl3固体--加热蒸干 | |
| B. | 除去Cu粉中混有的CuO--加入稀硝酸溶解、过滤、洗涤、干燥 | |
| C. | 分离NaNO3和BaSO4的混合物--溶解、过滤 | |
| D. | 除去NaOH溶液中混有的少量Na2SO4--加入BaCl2溶液、过滤 |
| A. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| B. | 对某一达到化学平衡状态的反应,若外界条件使反应速率改变,平衡一定会移动 | |
| C. | 在电解精炼铜的过程中,电解液中c(Cu2+)减小 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-11 |