题目内容
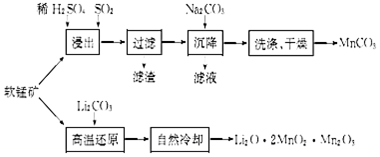
20.利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是( )
| A. | 电极a和电极c都发生氧化反应 | |
| B. | 电极d的电极反应式为2H++2e-=H2↑ | |
| C. | 装置X中通入SO2的速率为2.24L•min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为1.16L•min-1 | |
| D. | 装置X中每消耗64g SO2,理论上装置X和装置Y中均有1mol H+通过质子交换膜 |
分析 A装置能自发的进行氧化还原反应且没有外接电源,所以是原电池,a极上二氧化硫失电子为负极,b上氧气得电子为正极,B属于电解池,与电源的正极b相连的电极c为阳极,N2O4在阳极失电子生成N2O5,d为阴极,阴极上氢离子得电子生成氢气,据此分析.
解答 解:A.电极a为负极,电极c为阳极,负极和阳极都发生氧化反应,故A正确;
B.d为阴极,阴极上氢离子得电子生成氢气,电极d的电极反应式为2H++2e-=H2↑,故B正确;
C.电池的负极反应式为:SO2-2e-+2H2O=4H++SO42-,1min内n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,消耗水0.2mol,生成硫酸的质量为:0.1mol×98g/mol=9.8g,消耗水的质量为:0.2mol×18g/mol=3.6g,氢离子向右侧正极区定向移动0.2mol,即0.2g H+,设1min内通入xmLH2O,则有:$\frac{9.8g}{9.8g+x×1g/mol-3.6g-0.2g}$×100%=50%,x=13.6mL/min,故C错误;
D.装置X中每消耗64g SO2,即1mol,转移电子为2mol,由电荷守恒可知,理论上装置X和装置Y中均有2mol H+通过质子交换膜,故D错误.
故选CD.
点评 本题考查了原电池和电解池原理,题目难度中等,根据是否自发进行判断原电池和电解池,再结合各个电极上发生的电极反应分析解答,难点是电极反应式的书写,侧重于考查学的分析能力和计算能力.

练习册系列答案
相关题目
10.下列离子方程式只能表示一个化学反应的是( )
| A. | H++OH -=H2O | |
| B. | Cl -+Ag+=AgCl↓ | |
| C. | Cu 2++2OH -+Ba 2++SO42-=BaSO4↓+Cu(OH)2↓ | |
| D. | H++SO42-+OH-+Ba 2+=BaSO4↓+H2O |
11.下列有水参加反应中,属于氧化还原但水即不是氧化剂也不是还原剂的是( )
| A. | CaH2+2H2O═Ca(OH)2+2H2↑ | B. | 2F2+2H2O═4HF+O2 | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | 2Na2O2+H2O═4NaOH+O2↑ |
8.某芳香族化合物的分子式为C7H6Cl2,该有机物的可能结构有(不考虑立体异构)( )
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
5.按粒子的半径从小到大顺序排列的是( )
| A. | Cl、S、P | B. | N、O、F | C. | Na+、Mg2+、Al3+ | D. | K、Na、Li |
2.拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:
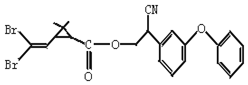
下列对该化合物叙述正确的是( )

下列对该化合物叙述正确的是( )
| A. | 属于芳香烃 | B. | 属于卤代烃 | ||
| C. | 有两种含氧官能团 | D. | 含苯环不含碳碳双键 |