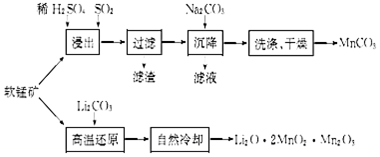
题目内容
3.实验室中用无水亚硫酸钠固体与足量的70%的硫酸反应制取1.12L(标准状况)二氧化硫气体,试计算:(1)若所用药品无水亚硫酸钠固体没有变质,则至少需要称取亚硫酸钠的质量为多少?
(2)若所用药品亚硫酸钠已有30%(质量分数)被氧化成了硫酸钠,则至少需称取该亚硫酸钠的质量为多少?
注:计算结果均保留一位小数.
分析 根据反应Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,由硫守恒可得:Na2SO3~SO2,根据关系式及二氧化硫的物质的量计算出需要亚硫酸钠的质量,由此分析解答;
解答 解:(1)若所用药品无水亚硫酸钠固体没有变质,由硫守恒可得:Na2SO3~SO2,因此需亚硫酸钠的质量为:m(Na2SO3)=126g•mol-1×$\frac{1.12L}{22.4L/mol}$=6.3g,答:至少需要称取亚硫酸钠的质量为6.3g;
(2)如果已有30%亚硫酸钠(质量分数),被氧化成硫酸钠,则含亚硫酸钠的质量分数为70%,
至少需称取该亚硫酸钠的质量为$\frac{6.3g}{70%}$=9.0g,
答:少需称取该亚硫酸钠的质量为9.0g.
点评 本题考查化学反应方程式的计算,为高频考点,题目难度不大,学生只要根据反应方程式列已知物与未物之间的关系就可以迅速解题了.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制.铝在下列使用场合中,不必要加以控制的是( )
| A. | 制造炊具 | B. | 制儿童玩具油漆 | C. | 制牙膏皮 | D. | 炼铝厂制造铝锭 |
14.某海域海水一些化学成分如表:
已知:25℃时,Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,Ksp=1.8×10-11.
某化学小组同学欲用该海水制备MgCl2,并提取Zn.设计流程如图:
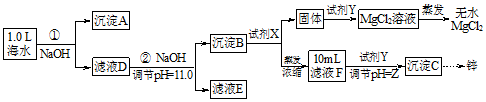
(1)写出生成沉淀A的化学方程式HCO3-+OH-+Ca2+=CaCO3↓+H2O.
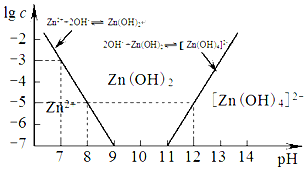
(2)如图为溶液pH与对应的Zn2+、2-物质的量浓度的对数坐标图,结合图中数据,由滤液F到沉淀C过程(一般认为离子浓度低于10-5 mol/L就是沉淀完全),则调节的pH的范围为8<pH<12.
(3)把MgCl2溶液蒸发得到无水MgCl2时,蒸发操作应该在在HCl气氛中环境中进行.
(4)试剂X为NaOH(写化学式).
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
某化学小组同学欲用该海水制备MgCl2,并提取Zn.设计流程如图:

(1)写出生成沉淀A的化学方程式HCO3-+OH-+Ca2+=CaCO3↓+H2O.
(2)如图为溶液pH与对应的Zn2+、2-物质的量浓度的对数坐标图,结合图中数据,由滤液F到沉淀C过程(一般认为离子浓度低于10-5 mol/L就是沉淀完全),则调节的pH的范围为8<pH<12.

(3)把MgCl2溶液蒸发得到无水MgCl2时,蒸发操作应该在在HCl气氛中环境中进行.
(4)试剂X为NaOH(写化学式).
11.下列有水参加反应中,属于氧化还原但水即不是氧化剂也不是还原剂的是( )
| A. | CaH2+2H2O═Ca(OH)2+2H2↑ | B. | 2F2+2H2O═4HF+O2 | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | 2Na2O2+H2O═4NaOH+O2↑ |
8.某芳香族化合物的分子式为C7H6Cl2,该有机物的可能结构有(不考虑立体异构)( )
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
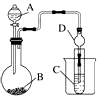 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.